
A növények egész életük során folyamatosan hoznak létre új szerveket. Ezt az teszi lehetővé, hogy szervképző régiókkal, ún. merisztémákkal rendelkeznek: ezek a hajtás, illetve a gyökér csúcsi részei, melyek a folyamatos növekedést és a szervek (levelek, virágok, gyökér) létrehozását teszik lehetővé a növény számára. Ezek a folyamatok egyrészt a növény fejlődési programja által meghatározottak, de a környezet is jelentősen befolyásolja őket, ezért nincsen két teljesen egyforma növény. A kutatások alapvető célja ennek a csak a növényekre jellemző rugalmas, a környezethez folyamatosan alkalmazkodó, egyedfejlődésnek a jobb megértése. A kutatócsoport néhány olyan molekuláris szabályozási lépést próbál meg azonosítani, amely szükséges a növények növekedésének és morfogenezisének fenntartásához, de egyben szerepet játszhat a környezeti hatások érzékelésében is. Ezek a mechanizmusok teszik lehetővé, hogy a növény növekedését a környezeti feltételekhez igazítsa. Ez napjainkban, a gyors klímaváltozás tükrében, különösen fontos kutatási terület. Laboratóriumunkban többek között a környezeti hőmérséklet néhány C0-fokos emelkedésének hatását vizsgáljuk a növények egyedfejlődésére (thermomorfogenezis). Alapvető biológiai ismereteink bővítése mellett, a kutatások hosszútávon elvezethetnek olyan növényfajták nemesítéséhez, melyek növekedése jobban alkalmazkodnak a változó termesztési feltételekhez vagy a változó környezeti feltételek mellet is változatlan növekedést mutatnak, illetve általában véve jobban megfelelnek a termesztési/felhasználási igényeknek.
A növények egyedfejlődése helyhez kötött életmódjuk következtében rendkívül rugalmas. A belső (fiziológiai, hormonális) és külső (környezeti) szignálok dinamikus kölcsönhatása biztosítja a növények folyamatos alkalmazkodását a változó környezeti feltételekhez. Laboratóriumunkban azokat a sejtszintű jelátviteli folyamatokat vizsgáljuk molekuláris és sejtbiológiai, valamint biokémiai, módszerekkel, amelyek megalapozzák a növények egyedfejlődésének ezt a nagyfokú rugalmasságát.
A növényi sejtosztódás és differenciálódás transzkripciós szabályozása
A kutatásaink középpontjába egyfelől olyan gének kerültek, amelyek a növekedés két alapvető folyamatát a sejtosztódást és a sejtmegnyúlást szabályozzák. Döntően ennek a két folyamatnak az egyensúlya határozza meg a növények illetve szerveik növekedésének a mértékét. A jelenlegi modell szerint az egyensúly molekuláris szabályozásában egy evolúciósan konzerválódott transzkripciós mechanizmus, az E2F-RB játszik kulcs szerepet. Az E2F transzkripciós faktor aktiválja az osztódásba lépéshez szükséges gének működését, míg a sejtciklus gátló, tumor szupresszor RETINOBLASZTOMA (RB) az E2F faktorhoz kötődve gátolja ezt. Az RB működését pedig az RB kinázok, specifikus ciklin-függő protein kinázok (CDK-CIKLIN komplexek) foszforiláció révén szabályozzák. Az E2F-RB szabályozási mechanizmus meglepően jól konzerválódott a növényekben is, így a molekuláris növénybiológiai kutatások modell növénye, az Arabidopsis thaliana, egyetlen RB-rokon fehérjével rendelkezik (RBR), amely három E2F-el képes komplexet lépni (E2FA, E2FB és E2FC). A jelenlegi modell szerint, az E2F transzkripciós faktorok a sejtosztódásba lépéshez fontos gének kizárólagos aktivátorai. Ezt a modellt a mag és az embrió fejlődése során teszteltük, és megállapíthattuk, hogy az E2F szabályozás egy olyan koordinációs mechanizmus központi eleme, amely a fejlődő magban elsősorban az osztódási és az érési folyamatok összehangolásában játszik meghatározó szerepet, míg meglepő módon a sejtosztódást aktiváló funkciója kevésbé hangsúlyos (1. Ábra).
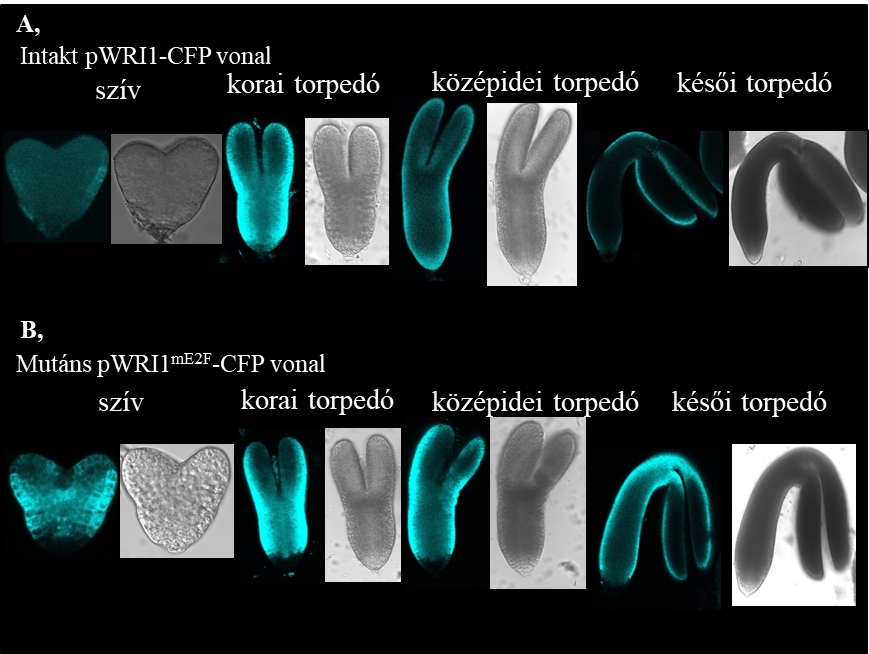
1. Ábra: A zsírsav szintézisben szerepet játszó embrió-specifikus WRINKLED 1 (WRI1) transzkripciós faktor megjelenését az E2F transzkripciós faktorok szabályozzák. A-B, Éretlen magokból izolált fejlődő transzformáns embriókról konfokális lézer scanning mikroszkóppal, fluoreszcens és látható tartományban készült reprezentatív képek, melyek az intakt (A) vagy az E2F kötőhelyben mutáns (B) WRI1 promótereket tartalmazzák (a képeken kék színű a cian-fluorescens protein - CFP riporter fehérje). Az intakt WRI1 promóter (pWRI-CFP) a sejtosztódás befejeződését követően a szív stádium után fejeződik ki, és a késői torpedó stádiumú embrióban már csak gyengén detektálható (A), míg az E2F-kötőhelyben mutáns WRI promóter (pmutE2FWRI1-CFP) az összes általunk vizsgált stádiumú embrióban magas szinten fejeződött ki (Leviczky és mtsai., 2019).
Kimutattuk az Arabidopsis levélfejlődése során, hogy az E2FB közvetlenül szabályozza a saját szabályozó molekuláinak a kifejeződését (RBR és CIKLIN D3;1). Ezek a negatív (RBR) és pozitív (CYCD3;1) visszacsatolási (feed-back) mechanizmusok biztosíthatják a levélfejlődése során a sejtosztódás és a differenciálódás közti egyensúly stabilitását. A növényi RBR, akárcsak az állati megfelelői fontos szerepet játszanak a genome stabilitás fenntartásában, és ebben a szabályozásban szorosan együttműködik az E2FA fehérjével. Az E2FB és az E2FC fehérjéket pedig együtt az RBR-rel, egy evolúciósan konzerválódott fehérje komplex részeként azonosítottunk (DREAM-komplex – 2. Ábra).
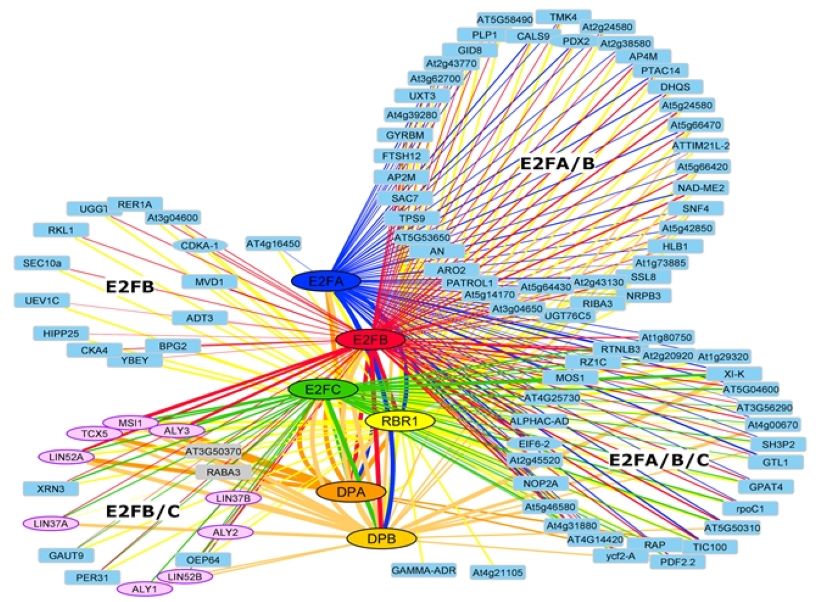
2. Ábra: Az E2F-DP és RBR fehérjék kölcsönható partnerei Arabidopsis csíranövényekben. Meta- tömespektrometriás analízis 182 immunprecipitálási kísérlet eredménye, amelyek E2F-, DP- és RBR-GFP-vel asszociált fehérjékkel történtek. Az E2FB és E2FC transzkripciós faktorok nemcsak a DP és RBR fehérjékkel, hanem DREAM (DP-RB-E2F-And-MYB-kölcsönható fehérjék) komponensekkel is komplexbe lépnek (rózsaszínnel jelölve – cytoscape ábrázolás – Lang és mtsai., 2021).
Ezek a növényi DREAM komplexek fontos szabályozó szerepet játszhatnak a sejtosztódás és a differenciálódás koordinálásában és a nyugalmi állapot kialakításában is. A nyugalmi állapot szabályozásáról növényekben keveset tudunk, pedig a kifejlett növényben a sejtek döntő többsége már nem osztódik. Ezek a nyugvó sejtek specifikus funkció ellátására terminálisan differenciálódtak, végleg elveszítetve az osztódási képességüket. Ide tartoznak ugyanakkor a növények osztódó, merisztematikus régióiban található őssejtek is, amelyek időlegesen nyugalmi állapotban vannak, de fejlődési és környezeti szignálok hatására visszaléphetnek az osztódásba. Kimutattuk, hogy az E2F transzkripciós faktorok a korábban feltételezett sejtosztódás aktivátor szereppel szemben, az RBR-rel komplexben gátolják a növények növekedését. Ezzel összhangban, a mindhárom E2F-re mutáns növény magasabbra nő, és nagyobb szerveket hoz létre, mint a kontrol növény (3. Ábra).
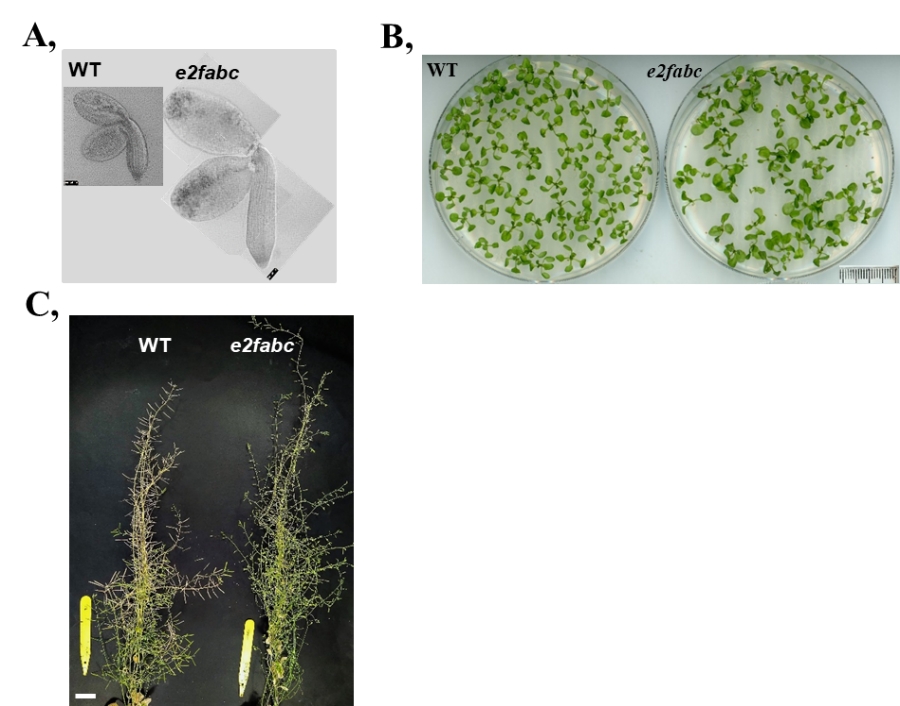
3. Ábra: Az e2fabc mutáns nagyobb növényi szerveket fejleszt és nagyobbra nő, mint a kontrol rokona. A, Az e2fabc tripla mutáns embriók sokkal nagyobbra nőnek, mint a kontrol vad típusú embriók (wild type=WT). B, Az in vitro nevelt e2fabc növények nagyobb leveleket fejlesztenek a kontrolhoz képest. C, A talajon nevelt Arabidopsis növények magasabbra nőnek, mint a kontrol vad típusúak (Gombos és mtsai., 2023).
Az E2F-ek az RBR-el alkotott gátló komplexeik révén meghatározó szerepet játszanak mind a terminális, mind pedig az átmeneti nyugalmi állapot kialakításában és fenntartásában (4. Ábra).
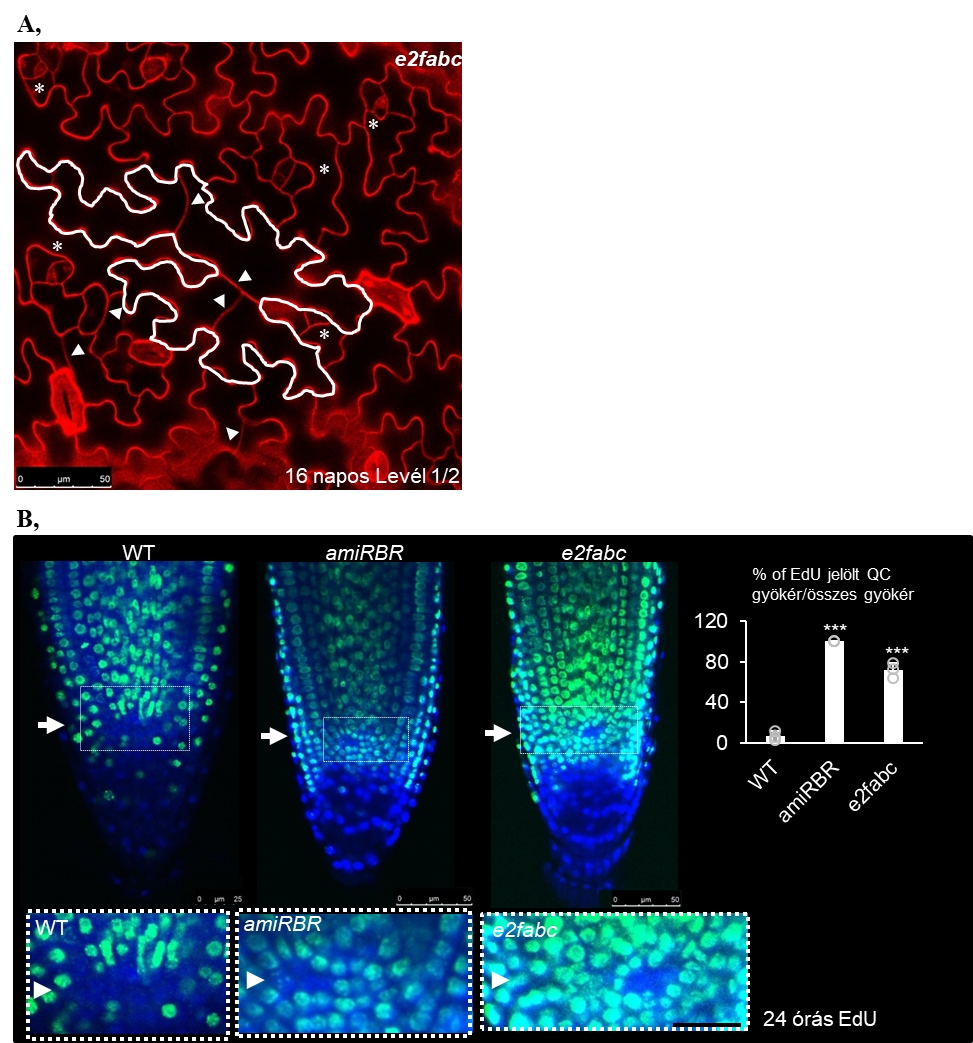
4. Ábra: A differenciált- és az őssejtek nyugalmi állapotát az E2F-RBR komplexek szabályozzák. A, Differenciált levél epidermisz lézer konfokális mikroszkópiával készített felvétele 16 nappal a csírázást követően. Propidium jódiddal (piros szín) festett e2fabc tripla mutáns levélbőrszövet (első levélpár: levél 1/2), nyílhegyek az új sejtfalakat mutatják már megnyúlt és differenciált állapotú epidermisz sejtekben (fehér körvonallal kiemelve egy bőrszöveti sejtet, mely már többszőr is osztódott). Csillag az osztódó zárósejt iniciálisokat jelzi. B, Vad típusú (wild type – WT), mesterséges mikroRNS-sel csendesített RBR (amiRBR) és e2fabc tripla mutáns vonalak gyökérmerisztéma lézer konfokális mikroszkóp alatt készített felvételei 24 órás EdU jelölést követően (zöld jel). A sejtmagok DAPI festéssel lettek jelölve (kék szín). Nyilak mutatják a nyugvó centrum (quiescent centre, QC) őssejtjek elhelyezkedését, és a fehér négyzettel jelölt területek alul kinagyítva láthatóak. A kontrol gyökerekhez képest az rbr és az e2fabc mutánsokban felgyorsult a QC sejtek osztódása, a grafikon az EdU-pozitív QC sejtek gyakoriságát ábrázolja (Gombos és mtsai., 2023).
A növényi morfogenezist befolyásoló jelátviteli utak
A növényi test felépítését alapvetően meghatározza a sejtek hormonok által közvetített kommunikációja, de a kapcsolódó intracelluláris jelátvitali hálózatokról az ismereteink még nagyon hiányosak. Ezenek a hálózatoknak az elemei a növényspecifikus receptor-szerű citoplazmatikus kinázok (RLCK-k). Laboratóriumunkban korábban kimutattuk, hogy ezeknek a kinázoknak az egyik csoportja Rho-of-plants (ROP) GTPázok által szabályozott. Ezek a kinázok állnak jelenleg a vizsgálataink középpontjában, mivel a ROP GTPázokról közismert, hogy a sejtek alakjának, növekedésük és osztódásuk irányultságának, fontos szabályozói. Mutáns és transzgenikus növények, élesztő és in vitro szűrési technikák, tranziens génkifejeződési vizsgálatok, konfokális mikroszkópia és in silico adatfeldolgozás segítségével szerzett biokémiai, szerkezeti, sejtbiológiai és funkcionális információk összegyüjtésén keresztül tártuk és tárjuk fel a ROP GTPáz-kapcsolt kinázok szerepét a sejtalak és méret szabályozásában a növényi morfogenezis során. Ezek az alapvető tudományos ismeretek hosszútávon elvezethetnek olyan molekuláris markerek és technológiák feltárásához, melyek lehetővé teszik a növények alakjának, fejlődésének a megváltoztatását.
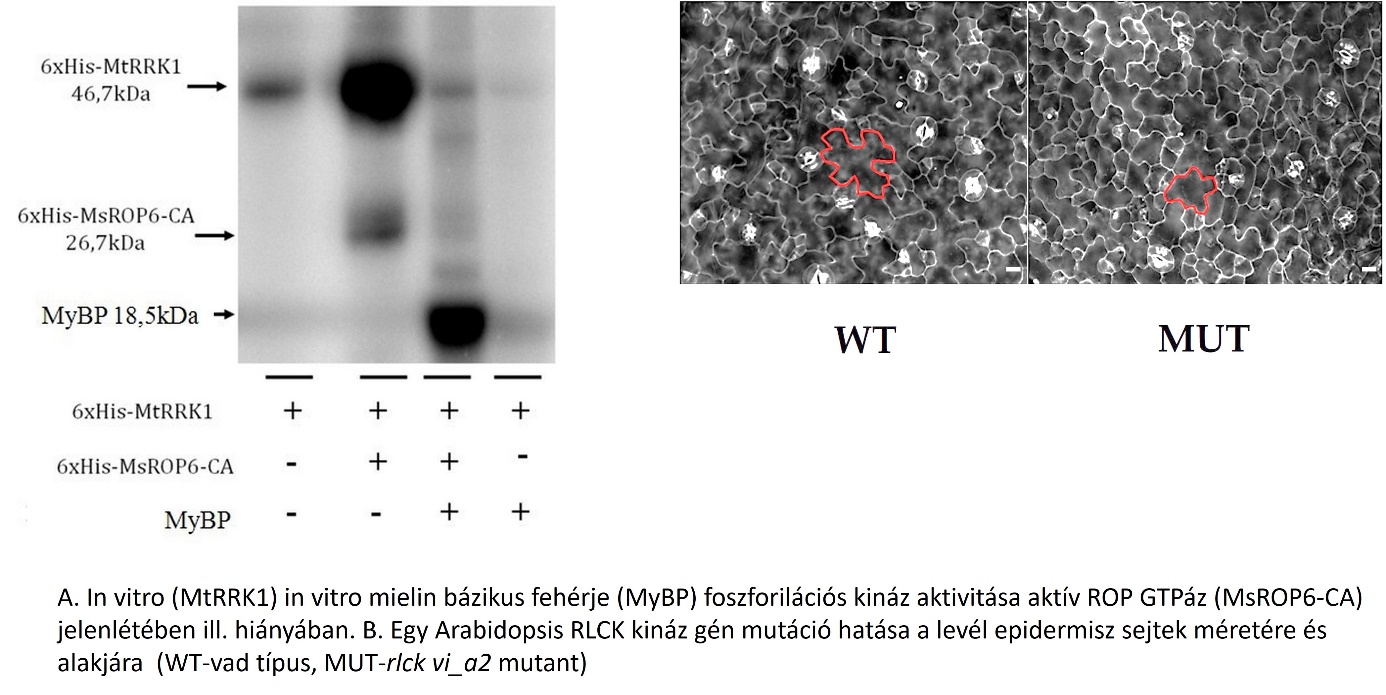
A növények in vitro regenerációs képessége
A növényi sejt- és szövettenyésztés már nagy múltra tekint vissza, és széles körben alkalmazzák a biotechnológiában, de a növények rendkívüli regenerációs képességének hátteréről hiányosak az ismereteink. Nem tudjuk például, hogy a testi sejtek hogyan veszítik el funkcióikat és nyerik vissza osztódási képességüket, azaz hogyan „dedifferenciálódnak”, mint ahogy arról is korlátozottak az ismereteink, hogy hogyan képesek újra teljes szerveket/növényeket regenerálni. Az in vitro növényregenerációs eljárások elterjedt alkalmazása ellenére számos faj/fajta létezik, amely testi sejtjei nem képesek a sejtosztódás újraaktiválására. Ide tartoznak a legfontosabb gabonafélék, ahol csak néhány genotípus fiatal szövetei alkalmasak in vitro tenyésztésre. Az adott genotípusú regenerált növényekből az új tulajdonság csak hosszas keresztezési program során vihető át a termeszett fajtákba. Ha minden egyes gabona fajta testi sejtjei közvetlenül felhasználhatóak lennének biotechnológiai alkalmazásokban, az nagy jelentőséggel bírna, különösen a genomszerkesztés korszakában. Így, annak megértése, hogy mi okozza a gabonafélék testi sejtjeinek in vitro tenyésztési nehézségeit, kiterjesztheti a növényi biotechnológiai megközelítések (mikroszaporítás, sejt fermentáció, sejtfúzió, genetikai sejt transzformáció, sejt-szintű szelekció, stb.) alkalmazhatóságát. Előzetes eredményeink azt mutatják, hogy az in vitro dedifferenciációt ugyanazok a faktorok irányíthatják, amelyek szabályozzák a sejtosztódás-differenciálódás váltást a növényi egyedfejlődés során. Célunk mutánsok és transzgenikus vonalak felhasználásával Arabidopsis esetében igazolni ezt a hipotézist, majd a megszerzett tudást kiterjeszteni a gabonafélékre. Egy másik megközelítésben azt vizsgáljuk, hogy a poliaminok metabolizmusa, illetve annak melléktermékei (pl. nitrogén monoxid, hidrogén peroxid), hogyan befolyásolják a növények in vitro regenerációs képességét. Végső célunk, hogy a fenti ismeretek birtokában megkerülhessük az in vitro regenerációra képtelen fajok testi sejtejeiben meglevő dedifferenciációs gátat.

Gyökérfejlődés Brachypodiumban, a LOB-domain transzkripciós faktorok szerepe
Ebben a projektben a szálkaperjét (Brachypodium distachyon) – a füvek és fontos gabonafélék, a búza, az árpa és a rozs – modellnövény rendszerét használjuk. Célunk, hogy megértsük, hogy a növényi sejtek alapvető döntése "osztódni, vagy differenciálódni", hogyan szabályozódik a növényiekben. Vizsgálataink tárgyául a gyökérfejlődést választottuk, mint fejlődési folyamatot, mivel az erős és hatékony gyökérzet kialakítása rendkívül fontos a növények túlélése szempontjából vízhiányos környezeti feltételek között.
Brachypodium genotípusok széles körét teszteltük eltérő szárazságtűrésük szempontjából, és a kiválasztott vonalakat részletesen jellemezzük gyökérnövekedésük és architektúrájuk meghatározásával vízhiány és hőmérsékletváltozás hatására. Kimutattuk, hogy vízhiány hatására a cirkadián óra működése megváltozik a gyökérzetben, és a gyökérzet prolin-anyagcseréje is a hajtástól eltérő módon szabályozódik a korlátozott vízellátás során.
A gyökér-architektúrát befolyásoló génjelöltek között elsősorban az ún. LOB-domén (oldalszerv-határ meghatározó) transzkripciós faktorok (TF) géncsaládját tanulmányozzuk, mely szálkaperjében 28 tagból áll (LBD gének), és alapvető expressziós jellemzésüket az elmúlt években végeztük el. Kiszűrtük mindazokat az LBD géneket, melyeknek működése megváltozik a gyökér egyes szegmenseiben termo-morfogenikus változások során. Az LBD fehérjék kölcsönhatásait jelenleg elsősorban számítógépes modellezéssel vizsgáljuk, de az esetleges ciklin/cdk-komplex általi foszforilációját is fel szeretnénk tárni, melyhez a CDK/ciklin és az E2F/RB szabályozási utak vizsgálata is szükséges Brachypodiumban. LBD mutánsok fenotípusos jellemzését tervezzük, valamint a sejtciklust szabályozó gének és a LOB-domén transzkripciós faktor gének expressziós analízisét ezekben a mutánsokban.
A várható eredmények jelentősen hozzájárulhatnak ismereteinkhez a növényi fejlődésbiológia területén. Annak ellenére, hogy az Arabidopsis fejlődésbiológiája hatalmas előrelépéseket mutat, mivel kétszikű növény, számos kérdést nem lehet megválaszolni ezzel a kiváló modell növénnyel. Ráadásul jól ismert, részben köszönhetően a mi korábbi eredményeinknek is, hogy lényeges különbségek vannak a sejtciklus szabályozásában az egyszikűek és a kétszikűek között. Ez a tény is szükségessé teszi egyszikű modell használatát is, így összehasonlíthatjuk az eredményeket az Arabidopsison kapottakkal. A gyökérfejlődés molekuláris genetikai hátterének megértése kiemelkedő fontosságú gyakorlati szempontokból is. A Brachypodium, mint a búza, az árpa és a rozs közeli rokon modellnövénye, lehetővé teszi számunkra, hogy az ezen a kicsi, gyorsan növekvő, és egyszerű fűfélén megszerzett tudásunkat a gyakorlatban is alkalmazhassuk a fenti nagy agronómiai jelentőségű növényeken is.


Növénynevelő kamrában nevelt bokrosodó és már kalászoló szálkaperje (Brachypodium distachyon) növények.

tudományos főmunkatárs

tudományos tanácsadó

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos segédmunkatárs

tudományos segédmunkatárs

PhD hallgató

vendégkutató

ügyvivő szakértő

laboráns
 MAGYAR Zoltán
MAGYAR Zoltán
|
tudományos főmunkatárs | publikációk | CV |
 FEHÉR Attila
FEHÉR Attila
|
tudományos tanácsadó | publikációk | CV |
 GYÖRGYEY János
GYÖRGYEY János
|
tudományos főmunkatárs | publikációk | CV |
 KENESI Erzsébet
KENESI Erzsébet
|
tudományos munkatárs | publikációk | CV |
 MOLNÁR Eszter
MOLNÁR Eszter
|
tudományos munkatárs | publikációk | CV |
 GOMBOS Magdolna
GOMBOS Magdolna
|
tudományos munkatárs | publikációk | CV |
 BENKŐ Péter
BENKŐ Péter
|
tudományos segédmunkatárs | publikációk | CV |
 NAGY Fruzsina
NAGY Fruzsina
|
tudományos segédmunkatárs | publikációk | CV |
 HLACS Attila
HLACS Attila
|
PhD hallgató | CV | |
 GÉMES Katalin
GÉMES Katalin
|
vendégkutató | publikációk | |
 KISS Edina
KISS Edina
|
ügyvivő szakértő | ||
 NAGY Róza
NAGY Róza
|
laboráns |