
Az új mikroszkópiás technikák kifejlesztésének köszönhetően napjaink biológiai és orvosi kutatása egyre inkább függővé vált a mikroszkópos képanalízistől. Ezek a technikák lehetővé teszik szinte bármelyik molekula specifikus jelölését, és ezáltal funkciójának közvetlen analízisét élő sejtekben, élőlényekben. Az új fejlesztések egyedi módon teszik lehetővé az alapvető sejtfolyamatok bonyolult tér-idő dinamikájának direkt megjelenítését és vizsgálatát. Laboratóriumunk egyik célja, hogy a legújabb képalkotó technikák, fluoreszcens jelölés és biokémiai technikák bevezetésével és továbbfejlesztésével lehetővé tegye magunk és mások számára a komplex sejten belüli és sejtek közötti rendeződések és folyamatok megértését és vizsgálatát. Legújabb eredményeink közé sorolhatjuk (i) a gyors és hatékony etinil dezoxiuridin (EdU) alapú replikációs analizis növényekre való használatának kidolgozását, (ii) újszerű fluoreszkáló festékek felfedezését és elemzését a növényi olaj cseppek vizsgálatához, (iii) az oligonukleotid irányított mutagenezisre alapozott gén-specifikus genom szerkesztésének hatékonyság-növelését a mutáns GFP és fluoreszkáló képalkotási technikák segítségével.
Mikroszkópos Sejtanalízis Laboratóriumunkban lézer-pásztázó konfokális mikroszkópok, spinning disc mikroszkóp, fluoreszcens és sztereó mikroszkópok, valósidejű élősejt-analízist lehetővé tevő mikroszkópos állomás és lézer mikrodisszekciós mikroszkóp található. Ezekkel a modern műszerekkel háromdimenzióban fehérje-lokalizációt és mobilitásvizsgálatot, valamint időbeli dinamikai analízist végezhetünk élő sejtekben, szövetekben, szervekben. A biológiai és orvosi alkalmazások mellett a lézer-pásztázó mikroszkópiának ipari alkalmazásai is vannak, mint például a mikro-elektromechanikai rendszerek vizsgálata, meghibásodás illetve hajszálrepedések tesztelése, ellenőrzése. Úgyszintén széles körben alkalmazható az anyagtudományok terén is.
A sejtosztódás DNS-szintézis fázisában (S-fázis) lévő sejtek jelölése, detektálása és kvantifikálása kulcsfontosságú a vizsgálandó sejtek különböző kezelésekre és genetikai módosításokra való válaszának elemzése során. A sejtek bromdezoxiuridinnel-való (BrdU) jelölése és ellenanyaggal való detektálása eddig az S-fázis leggyakrabban használt elemzési módszere volt. Az ellenanyaggal való BrdU-detektálás módszere savas vagy nukleázzal történő, nem kíméletes lépéseket tartalmaz. A növényi sejtfalak külön akadályt jelentenek az ellenanyag-függő módszerek alkalmazásában, ezért sejtfalemésztést igényelnek. Ezek a lépések nem csak időigényesek, hanem a sejt morfológiáját is torzítják. Konfokális lézer-pásztázó mikroszkópia és áramlásos citometria együttes használatával kimutattuk, hogy az újszerű etinil dezoxiuridin alapú módszer kifejleszthető és számos szempontból előnyösebb a bromdezoxiuridin metodikával szemben, növények esetében. Laboratóriumunk közleményeinek köszönhetően ez az újszerű replikációs analízis technika a növényi sejtciklus/sejtosztódás kutatás területén egyre népszerűbbé vált. (Kotogany et al., 2010, Ayaydin et al., 2011, Kuntam and Ayaydin, 2015)
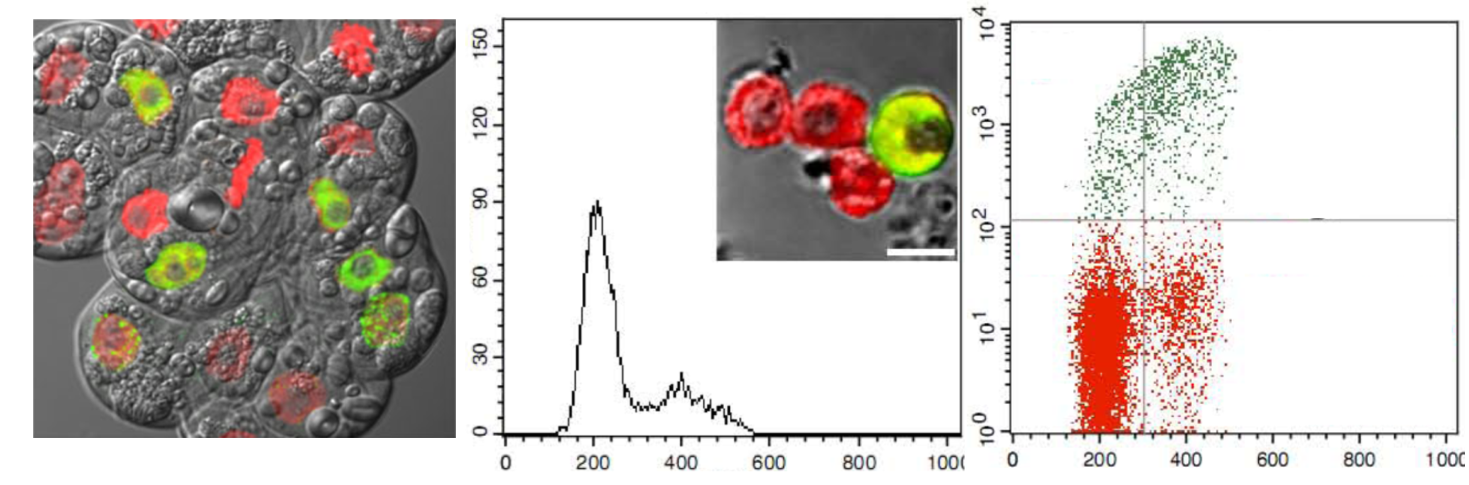
Újszerű replikációs analízis módszer növényekben
A növényi olajcseppek (Lipid droplets) nagyon dinamikusak. A proteomikai analízisek kimutatták, hogy számos különböző fehérje helyezkedik el a növényi olajcseppek felületén. Azonban kevés tudással rendelkezünk az olajcseppek fehérje- és lipidtartalmának szabályozottságáról, a különböző fehérjék olajcseppekre való jutásának mechanizmusairól, az olajcseppek kialakulásáról, illetve, a sejten belüli mozgásukról. Ezért az élősejtekben végzett dinamikus analízisek nagyon fontos szerepet játszanak ezen organellum biológiájának megértésében. Kutatásaink során kimutattuk, hogy a talidomid alapú újszerű, olajcsepp-jelölő fluoreszkáló festékek használata kifejezetten előnyös az élő-növényi sejtek 3 dimenziós, mikroszkópos analízisére. Kék fluoreszkáló színüknek köszönhetően ezek az új festékek zöld és piros színű más festékekkel és fluoreszkáló fehérjékkel is kombinálhatóak. (Kuntam et al., 2015)
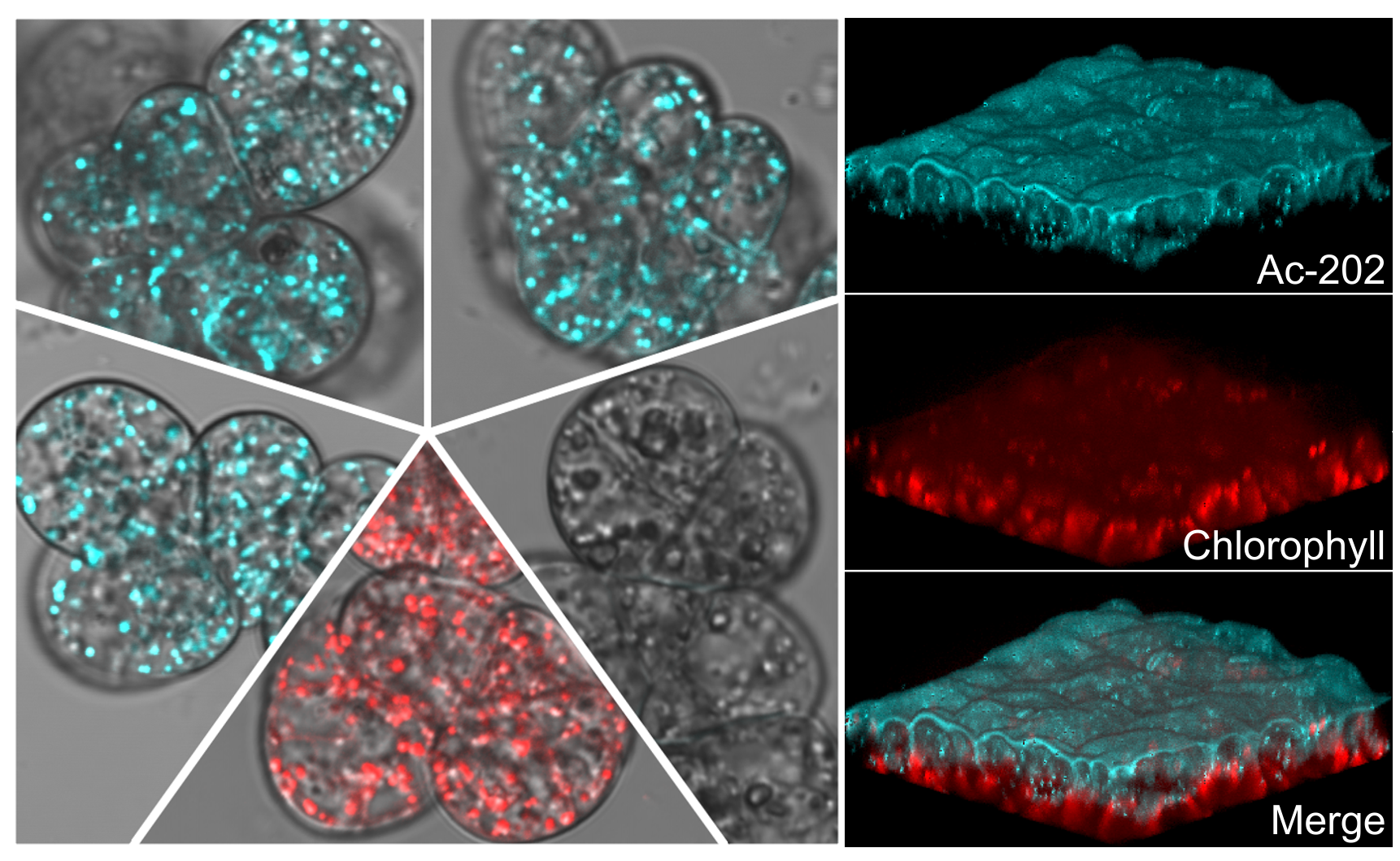
Új fluoreszkáló festékek a növényi olajcsepp jelöléséhez
A mutációs nemesítés és a gén-transzfer alapú genetikai módosítás (GMO) technikák alternatívájaként alkalmazható gén-specifikus genomszerkesztési technika fontos szerepet játszhat a növénynemesítésben. Az oligonukleotid irányított mutagenezis (ODM) mint módszer a gén-specifikus nukleotid csere (TNE) technikákban különösen kulcsszerepet játszhat mind az alapkutatás területén, mind a növénynemesítésben. Viszont ennek a technikának az egyik fő korlátja a nukleotidcsere események rendkívüli ritkasága. Dudits Dénes professzorral (HUN-REN SZBK, Növénybiológiai Intézet) együttműködve a kromatin-módosító vegyszerek segítségével és a mutáns GFP fehérje használatával szignifikáns hatékonyságemelést értünk el a nukleotidcsere eseményekben kukoricasejtek esetében. Úgy gondoljuk, hogy ezen a területen elért eredményeink nem csak az alapkutatásban, hanem transzgén-mentes növénynemesítés területén is fontos szerepet fognak játszani (Tiricz et al, 2015).
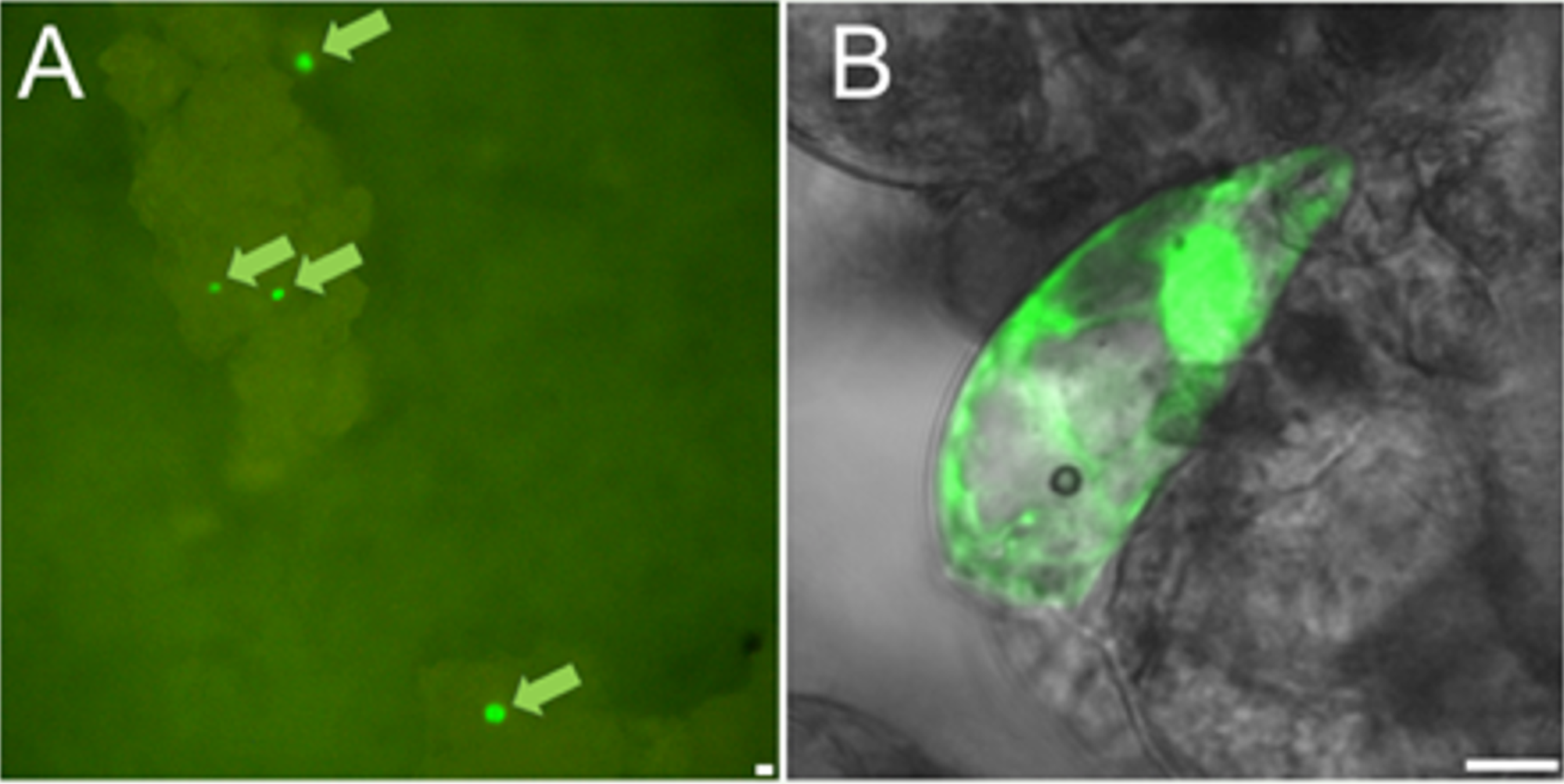
Mutáns GFP fluoreszcencia helyreállítása oligonukleotid-irányított mutagenezis technikával
A mindennapi létfenntartásunkhoz nélkülözhetetlen az ipari tevékenység, és a gyártási folyamatok mellléktermékeként ún. ipari toxikus vegyületek keletkeznek. Ezeknek a mérgező vegyületeknek különböző veszélyességi szintje lehet, különböző halmazállapotban fordulhatnak elő, és nemcsak a gyártási folyamat során, hanem tárolásuk és szállításuk közben is megjelenhetnek a környezetünkben. E vegyületek az ember számára a beléglégzés során, a bőrrel való érintkezés vagy lenyelés útján válhatnak veszélyessé. Egészségünk szempontjából kulcsfontosságú, hogy minél pontosabban meg tudjuk mérni ezen anyagok mennyiségét a környezetünkben, lehetőleg időben azonnal, valamint folyamatosan nyomon tudjuk követni a szintjüket. A 2019-ben indult bilaterális pályázatunk (NKFI TR-NN_17 Magyarország-Törökország célja), hogy érzékeny bioszenzort kísérletezzen ki, amely alkalmas a levegőben gáz halmazállapotban jelenlévő ipari toxikumok folyamatos nyomon követésére. A világon több erőfeszítés is folyik a környezetünkben lévő mérgező vegyületek gyors és pontos detektálásának fejlesztésére. Az általunk javasolt kutatás és az erre alapozott megoldás egyedi abban a tekintetben, hogy várhatóan igen magas érzékenységű, azonnali adatgyűjtést és továbbítást tesz lehetővé, és emellett időben folyamatosan, nagyobb földrajzi területen képes a vegyületek jelenlétéről adatot szolgáltatni. Laboratóriumunkban sikerült egy kisméretű fluoreszcens detektáló rendszert összeállítanunk, amely készen áll a drón-integrációra is.

Levegőszennyezettség monitorozása drón-integrált flureszcens bioszenzor baktériumok segítségével
A DP mikroszkópia segítségével – a poláros fény és az anyag kölcsönhatásából származó spektropolarimetriai mennyiségek képpontonkénti, illetve 3D-ben voxelenkénti mérésével – a vizsgált minták anizotróp szerkezetének legfontosabb jellemzőiről készíthetünk, konfigurációtól függően, 2D vagy 3D térképet. Mikroszkópos minták anizotróp szerkezetéről – különösen a biológiában – ma még nagyon keveset tudunk; számos példa bizonyítja azonban, hogy az önszerveződő élő anyag magasan szervezett molekuláris rendszerei felépítésében az anizotrópia változatos formái jelen vannak. Ezek feltárása és részletes jellemzése viszont általában csak mikroszkópiás eljárással végezhető el – ez indokolja a mikroszkópos méréstechnikai fejlesztések és a berendezéssel végzett kutatások szükségességét.
Az eddigiekben összeállított DP-LSM (lézer-pásztázó mikroszkóp) berendezéseink segítségével hazai és nemzetközi együttműködések keretein belül leképeztük – többek között – kloroplasztiszok kettőstörésének a gránumos szerkezethez köthető, lokális értékeit, ami a membránok optikai csipeszes mikromanipulációját teszi lehetővé; limfocita sejtmembránok doménszerkezetét, ami immunológiai kutatásokban hasznos ismereteket eredményezett; továbbá különböző kezeléseknek alávetett növényi sejtfalak szerkezetét – ez utóbbi munkák a cellulóz energetikai felhasználása során válhatnak különösen érdekessé. Kimutattuk aktin-alapú szerkezetek szerveződését biztosító fehérjék szerepét a sejtfejlődésben, humán amiloidok szerkezeti stabilitását biztosító makrohelikális szerkezeteket azonosítottunk, amelyek neurodegeneratív betegségekben játszanak szerepet; meghatároztuk önszerveződő porfirin-alapú ún. mesterséges kloroszóma (fénybegyűjtő nanoszerkezetek) kromofórjainak orientációját – ilyen spontán felépülő molekuláris rendszerek fotokatalitikus rendszerekben használhatók.

FDLD leképezés Ginkgo biloba szöveten differenciál-polarizációs újrapásztázó konfokális mikroszkóppal
Ayaydin, F., Vissi, E., Meszaros, T., Miskolczi, P., Kovacs, I., Feher, A., Dombradi, V., Erdodi, F., Gergely, P. and Dudits, D. (2000). Inhibition of serine/threonine-specific protein phosphatases causes premature activation of cdc2MsF kinase at G2/M transition and early mitotic microtubule organization. Plant J. 23(1):85-96.
Ayaydin, F. and Dasso, M. (2004). Distinct in vivo dynamics of vertebrate SUMO paralogues. Mol. Biol. Cell 15(12):5208-5218.
Mukhopadhyay D, Ayaydin F., Kolli N., Tan S.H., Anan T., Kametaka A., Azuma Y., Wilkinson K.D., Dasso M. (2006). SUSP1 antagonizes formation of highly SUMO2/3-conjugated species, J Cell Biol. 174: 939-949.
Kotogány, E., Dudits, D., Horváth, V.G. and Ayaydin F. (2010). A rapid and robust assay for detection of S-phase cell cycle progression in plant cells and tissues by using ethynyl deoxyuridine. Plant Methods (6:5)
Ayaydin, F., Kotogány E., Ábrahám E and Horváth V.G. (2011). Synchronization of Medicago sativa Cell Suspension Culture. Methods Mol Biol. 761:227-238.
Fazakas C., Wilhelm I., Nagyoszi P., Farkas A.E., Haskó J., Molnar J., Bauer H., Bauer H.C., Ayaydin F., Dung N.T.K., Siklós L., Krizbai I.A. (2011). Transmigration of melanoma cells through the blood-brain barrier: role of endothelial tight junctions and melanoma-released serine proteases, PLOS ONE 6: (6) e20758.
Rigo G., Ayaydin F., Tietz O., Zsigmond L., Kovacs H., Pay A., Salchert K., Darula Z., Medzihradszky K.F., Szabados L., Palme K., Koncz C., Cseplo A. (2013). Inactivation of Plasma Membrane-Localized CDPK-RELATED KINASE5 Decelerates PIN2 Exocytosis and Root Gravitropic Response in Arabidopsis. Plant Cell 25:1592-1608.
Gungor B., Gombos I., Crul T., Ayaydin F., Szabo L., Torok Z., Mates L., Vigh L., Horvath I. (2014). Rac1 participates in thermally induced alterations of the cytoskeleton, cell morphology and lipid rafts, and regulates the expression of heat shock proteins in B16F10 melanoma cells. PLOS ONE 9:(2) p. e89136.
Steinbach G, Pawlak K, Pomozi I, Tóth EA, Molnár A, Matkó J, Garab G (2014) Mapping microscopic order in plant and mammalian cells and tissues: novel differential polarization attachment for new generation confocal microscopes (DP-LSM). Methods and Applications in Fluorescence 2: 015005 (9pp)
Kuntam S., Puskás L.G., Ayaydin F. (2015). Characterization of a new class of blue-fluorescent lipid droplet markers for live-cell imaging in plants. Plant Cell Rep. 34:655-665.
Kuntam S. and Ayaydin F.(2015) Detection of S-phase of cell division cycle in plant cells and tissues by using 5-ethynyl-2’-deoxyuridine (EdU) in Plant Microtechniques: Methods and Protocols. Eds. Yeung C.T.E., Stasolla C, Sumner M.J., Huang B.Q. Springer, pp. 311-322.
Horvath B., Domonkos A., Kereszt A., Szucs A., Abraham E., Ayaydin F., Boka K., Chen Y., Chen R., Murray J.D., Udvardi M.K., Kondorosi E., Kalo P. (2015) Loss of the nodule-specific cysteine rich peptide, NCR169, abolishes symbiotic nitrogen fixation in the Medicago truncatula dnf7 mutant. Proc. Natl. Acad. Sci. USA 112:15232-15237.
Steinbach G, Schubert F, Kaňa R (2015) Cryo-imaging of photosystems and phycobilisomes in Anabaena sp. PCC 7120 cells. Journal of Photochemistry and Photobiology B: Biology, 152: 395–399
Dudits D., Török K., Cseri A., Paul K., Nagy A.V., Nagy B., Sass L., Ferenc G., Vankova R., Dobrev P., Vass I., Ayaydin F. (2016) Response of Organ Structure and Physiology to Autotetraploidization in Early Development of Energy Willow Salix viminalis. Plant Physiol. 170:1504-1523.
Steinbach G, Kaňa R (2016) Automated microscopy: macro language controlling a confocal microscope and its external illumination – adaptation for photosynthetic organisms. Microscopy and Microanalysis, 22: 258–263
Tiricz H., Nagy B., Ferenc G., Török K., Nagy I., Dudits D. and Ayaydin F. (2017) Relaxed chromatin induced by histone deacetylase inhibitors improves the oligonucleotide-directed gene editing in plant cells. J Plant Res 131(1):179-189.
Fodor E and Ayaydin F. (2018) Fluorescent probes and live imaging of plant cells. “Advances in Plant Ecophysiology Techniques” Eds: Reigosa MJ, Sánchez-Moreiras A. Publisher: Springer Nature pp. 241-251
Steinbach G, Nagy N, Sipka G, Manders E, Garab G, Zimanyi L (2019) Re-scan confocal microscope modified for anisotropy imaging – as a part of a differential polarization system. European Biophysics Journal 48: 457–463. 2019
Strašková A, Steinbach G, Kotabová E, Komenda J, Tichý M, Kaňa R (2019) Pigment-protein complexes are organized into stable microdomains in cyanobacterial thylakoids. Biochimica et Biophysica Acta (BBA) – Bioenergetics, 1860, 148053
Kana R, Steinbach G, Sobotka R, 1 , Vámosi G, Komenda J (2021) Fast Diffusion of the Unassembled PetC1-GFP Protein in the Cyanobacterial Thylakoid Membrane. Life 11: 15, 2021
Bernát, G., Zavřel, T., Kotabová, E., Kovács, L., Steinbach, G., Vörös, L., Prášil, O., Somogyi, B., Tóth, V. R. (2021) Photomorphogenesis in the Picocyanobacterium Cyanobium gracile Includes Increased Phycobilisome Abundance Under Blue Light, Phycobilisome Decoupling Under Near Far-Red Light, and Wavelength-Specific Photoprotective Strategies. FRONTIERS IN PLANT SCIENCE 12 Paper: 612302 , 16 p. (2021)
Pleckaitis, M., Habach, F., Kontenis, L., Steinbach, G., Jarockyte, G., Kalnaityte, A., Domonkos, I., Akhtar, P., Alizadeh, M., Bagdonas, S., Karabanovas, V., Garab, G., Rotomskis, R., Barzda, V. (2022) Structure and principles of self-assembly of giant "sea urchin" type sulfonatophenyl porphine aggregates. NANO RESEARCH 15 : 6 pp. 5527-5537. , 11 p. (2022)
Dudits, D., Cseri, A., Török, K., Vankova, R., Dobrev, P. I., Sass, L., Steinbach, G., Kelemen-Valkony, I., Zombori, Z., Ferenc, G., Ayaydin, F. (2023) Manifestation of Triploid Heterosis in the Root System after Crossing Diploid and Autotetraploid Energy Willow Plants. GENES 14 : 10 p. 1929