
A szív és érrendszeri megbetegedéseket a daganatos betegségek követik a halálozási statisztikákban. Magyarországon a legmagasabb a rák miatti halálozási ráta az Európai Unióban; a rák már az összes haláleset 26 százalékáért felel. Bár szokás a daganatokat származási szövetük szerint, valamint áttétképző tulajdonságuk alapján csoportosítani, mégis, abban a tulajdonságukban, hogy a saját sejtjeinkből származnak, minden tumor megegyezik.

Ahhoz, hogy normál testi sejtjeink daganatos sejtként kezdjenek viselkedni, működésük megváltozására van szükség. Tudjuk, hogy a velünk érintkezésbe kerülő mutagének növelik a rák előfordulásának kockázatát, ezért a megváltozott működés kialakulásában jelentős szerepet tulajdoníthatunk a mutagének DNS-károsító képességének. A megváltozott információtartalmú genom megváltozott működésű fehérjékhez vezet. Ezek a megváltozott fehérjék akár olyan új funkciókra is szert tehetnek, amelyek a testi sejtet folyamatos osztódásra késztetik, majd a szelekciós nyomás hatására létrejönnek olyan sejtváltozatok is, amelyek képesek saját tápanyagellátásukról gondoskodni, illetve akár idegen szöveti környezetben is tovább osztódni.
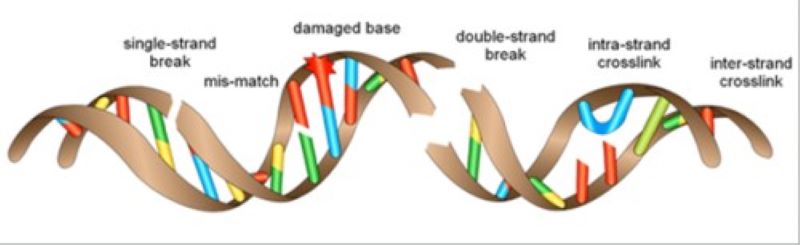
A mutagének hatására ugyan károsodik a DNS, ez azonban nem vezet közvetlenül mutációkhoz, hiszen minden sejtünkben, minden nap több százezerre tehető a különböző DNS-károsodások száma. A DNS-t hibajavító mechanizmusok védik attól, hogy ezek a károsodások maradandóan mutációkká konvertálódjanak.
Kutatócsoportunk azokat a folyamatokat vizsgálja, amelyek utolsóként állhatnak a báziskárosodások sejtpusztító hatásának útjába. A mutagének által módosított bázisok elsősorban a DNS-replikáció során jelenthetnek a másoló mechanizmusok számára olyan akadályt, amelyen azok csak egy nem megfelelő nukleotid beépítésével juthatnak tovább. Erre a folyamatra az egyik legjobb példa az UV sugárzás hatására, a bőr szöveteiben lejátszódó események. Ilyenkor az UV sugárzás az egymással szomszédos bázisokat, például timineket kovalensen keresztkötheti. Ezeket a módosult bázisokat a másolást végző DN-polimeráz már képtelen felismerni és velük szemben a helyes nukleotidokat beilleszteni. Az osztódó sejt számára ez az eset halálos lehet. Aktiválódhat azonban a Rad6 és Rad18 fehérjék által szabályozott mechanizmus, mely során a replikációs polimeráz lecserélődhet olyan kis pontossággal másoló DNS-polimerázra (TLS polimerázra), például a polη-ra, amely képes ezekkel az összekötött timinekkel szemben a helyes adeninok beépítésére. Sok esetben azonban ezek a TLS polimerázok nem a helyes nukleotidot építik be. Minden ilyen esetben egy mutáció az ára a replikáció folytatásának és a sejt túlélésének. Ez akkor jelent kevésbé problémát a sejt számára, ha a kérdéses pozícióban nem tárolódik az utódsejtek számára szükséges információ.
Létezik olyan mechanizmus is, amely képes az elakadt replikációs villát hibamentesen átsegíteni a kritikus ponton, ez azonban sérülékeny DNS-struktúrákon keresztül történik, ezért nem minden esetben megfelelő. Csoportunk elsőként talált bizonyítékot arra, hogy az élesztő Rad5 fehérje képes katalizálni ilyen folyamatokat (1), és elsőként találtuk meg ennek a fehérjének az emberi megfelelőjét az SHPRH és a HLTF enzimekben (2,3,4). A humán sejtekben lévő HLTF fehérje számos tumortípusban inaktív, és hiánya növeli a kromoszóma-rendellenességek gyakoriságát, jelezve a genom stabilitásában és a tumorszupresszióban betöltött jelentőségét. Csoportunk megvizsgálta és bizonyította a HLTF fehérjein vivo szerepét a posztreplikációs repair DNS-hiba-javítási folyamatban és jellemezte különböző doménjeinek szerepét (5).
A DNS-hiba-tolerancia útvonalban szabályozó szerepet tölt be a Spartan fehérje, melynek pontos funkciója ez idáig ismeretlen volt. Csoportunk kimutatta, hogy a Spartan fehérje a DNS-fehérje keresztkötéseket tartalmazó DNS replikációjában játszik szerepet: DNS-függő proteáz aktivitása révén eltávolítja a keresztkötött fehérjéket. A csoport a Spartan fehérje egy új biokémiai jellemzőjét is meghatározta azáltal, hogy kimutatta a tisztított humán fehérje DNS-kötő képességét és bizonyította, hogy e funkciója részt vesz a Polη transzléziós polimeráz DNS károsodás helyére történő irányításában (6).
Ezek az újonnan felfedezett fehérjék kitűnő célpontokként szolgálhatnak rákterápiás szereknek, hiszen a jelenleg forgalomban lévő kemoterápiás szerek egy része (ciszplatin, mitomicin C, stb.) hatásukat a DNS károsításán és ezen keresztül a gyorsan osztódó daganatsejtek osztódásának blokkolása révén fejtik ki. Feltételezhető, hogy amennyiben gátoljuk azokat a rendszereket, amelyek képesek a blokkolt replikáció mentésére, a tumorsejtek nagyobb arányban fognak elpusztulni.
Azt, hogy pontosan mi történik, ha a DNS másolása elakad, mikor melyik útvonal fog a replikációs villánál érvényesülni, egy szövevényes, sokszorosan túlbiztosított, érzékeny mechanizmus befolyásolja, hiszen mutáció beépítése csak a legvégső esetben történhet. Jól példázza ezt, hogy több bizonyítékunk is van in vivo lokalizációs és immunprecipitációs kísérletekből, valamint in vitro fehérje-fehérje kölcsönhatási kísérletekből olyan fehérje faktorok szerepére a Rad6-Rad18 útvonallal összefüggésben, amelyeket eddig nem (7, 8) vagy esetleg más betegségekkel (Fanconi anémia) kapcsolatban azonosítottak.
Laborunkban kifejlesztettünk egy olyan módszert is, amellyel képesek vagyunk követni a replikációs villa helyreállásának időbeliségét. Ez lehetőséget nyújt arra, hogy célzott géncsendesítéssel vizsgáljuk egy-egy fehérje szerepét a replikációs villa mentésében és ennek szabályozásában. Arra is lehetőséget ad, hogy feltárjuk, melyik másik folyamat képes átvenni a helyét egy-egy kiesett funkciónak.
A fentiekből jól következik, hogy ha a károsított DNS replikációjában szerepet játszó gének közül valamelyik nem, vagy hibásan működik, az erősen megnöveli a daganat kialakulásának kockázatát. A tumoros megbetegedések néhány esetben családi halmozódást mutatnak. Az ilyen terhelt családok közül sok esetben nem sikerül megtalálni a kiváltó okot. Ehhez nyújt segítséget az újgenerációs szekvenálás (NGS) megjelenése. Ezzel a technikával laboratóriumunkban is elérhetővé vált nagyszámú betegen, több gén egyidejű szekvenálása, illetve emberi tumorból származó mintákban meghatározhatjuk, hogy az általunk vizsgált gének közül melyik szenvedett mutációt és milyen százalékban.
Mivel ezek a gének közvetlenül érintettek a mutációk megjelenésében, érdekes lehet az a kérdés, hogy hiányuk vagy éppen túlműködésük mennyire befolyásolja a sejtekben a mutációs rátát. Jelenleg is folytatunk olyan kísérleteket, amelyek segítenek meghatározni, hogy a mutációk számában és minőségében milyen változások történnek bizonyos karcinogének hatására, vagy ha adott géneket inaktiválunk.

A gyakran elhangzó „mikor találják meg a rák ellenszerét” kérdésre az egyszerű válasz: soha. Minden daganatot külön entitásként kell kezelni, hiszen még egy adott tumorban sem egységes a daganatsejtek genetikai háttere. Sokkal biztatóbb válasz azonban az, hogy évről évre közelebb jutunk a lehetséges támadási pontok azonosításához, hogy végül az egyénre és daganatra szabott terápia segítségével az időben észlelt tumor komoly áldozatok nélkül leküzdhető legyen.
Válogatott közlemények
1. Yeast Rad5 protein required for postreplication repair has a DNA helicase activity specific for replication fork regression. Blastyák A, Pintér L, Unk I, Prakash L, Prakash S, Haracska L. Mol Cell. 2007 Oct 12;28(1):167-75.
2. Human HLTF functions as a ubiquitin ligase for proliferating cell nuclear antigen polyubiquitination. Unk I, Hajdú I, Fátyol K, Hurwitz J, Yoon JH, Prakash L, Prakash S, Haracska L. Proc Natl Acad Sci U S A. 2008 Mar 11;105(10):3768-73. doi: 10.1073/pnas.0800563105. Epub 2008 Mar 3.
3. Role of double-stranded DNA translocase activity of human HLTF in replication of damaged DNA. Blastyák A, Hajdú I, Unk I, Haracska L. Mol Cell Biol. 2010 Feb;30(3):684-93. doi:10.1128/MCB.00863-09. Epub 2009 Nov 30.
4. Coordinated protein and DNA remodeling by human HLTF on stalled replication fork. Achar YJ, Balogh D, Haracska L. Proc Natl Acad Sci U S A. 2011 Aug 23;108(34):14073-8. doi:10.1073/pnas.1101951108. Epub 2011 Jul 27.
5. Human HLTF mediates postreplication repair by its HIRAN domain-dependent replication fork remodelling. Achar YJ, Balogh D, Neculai D, Juhasz S, Morocz M, Gali H, Dhe-Paganon S, Venclovas Č, Haracska L. Nucleic Acids Res. 2015 Dec 2;43(21):10277-91. doi: 10.1093/nar/gkv896. Epub 2015 Sep 8.
6. DNA-dependent protease activity of human Spartan facilitates replication of DNA-protein crosslink-containing DNA. Mórocz M, Zsigmond E, Tóth R, Enyedi MZ, Pintér L, Haracska L. Nucleic Acids Res. 2017 Apr 7;45(6):3172-3188. doi: 10.1093/nar/gkw1315. PMID: 28053116
7. Role of SUMO modification of human PCNA at stalled replication fork. Gali H, Juhasz S, Morocz M, Hajdu I, Fatyol K, Szukacsov V, Burkovics P, Haracska L. Nucleic Acids Res. 2012 Jul;40(13):6049-59. doi: 10.1093/nar/gks256. Epub 2012 Mar 28.
8. Characterization of human Spartan/C1orf124, an ubiquitin-PCNA interacting regulator of DNA damage tolerance. Juhasz S, Balogh D, Hajdu I, Burkovics P, Villamil MA, Zhuang Z, Haracska L. Nucleic Acids Res. 2012 Nov;40(21):10795-808. doi: 10.1093/nar/gks850. Epub 2012 Sep 16.
9. The Combination of Single-Cell and Next-Generation Sequencing Can Reveal Mosaicism for BRCA2 Mutations and the Fine Molecular Details of Tumorigenesis. Gráf A, Enyedi MZ, Pintér L, Kriston-Pál É, Jaksa G, Bálind Á, Ezer É, Horváth P, Sükösd F, Kiss E, Haracska L. Cancers (Basel). 2021 May 13;13(10):2354. doi: 10.3390/cancers13102354. PMID:34068254
10. Coordinated Cut and Bypass: Replication of Interstrand Crosslink-Containing DNA. Li Q, Dudás K, Tick G, Haracska L.Front Cell Dev Biol. 2021 Jun 28;9:699966. doi:10.3389/fcell.2021.699966. eCollection 2021.PMID: 34262911
11. BC-Monitor: Towards a Routinely Accessible Circulating Tumor DNA-Based Tool for Real-Time Monitoring Breast Cancer Progression and Treatment Effectiveness. Priskin K, Pólya S, Pintér L, Jaksa G, Csányi B, Enyedi MZ, Sági-Zsigmond E, Sükösd F, Oláh-Németh O, Kelemen G, Nikolényi A, Uhercsák G, Sántha D, Dobi Á, Szilágyi É, Valicsek E, Tordai L, Tóth R, Kahán Z, Haracska L.Cancers (Basel). 2021 Jul 12;13(14):3489. doi: 10.3390/cancers13143489.PMID: 34298704
12. A series of xanthenes inhibiting Rad6 function and Rad6-Rad18 interaction in the PCNA ubiquitination cascade. Fenteany G, Sharma G, Gaur P, Borics A, Wéber E, Kiss E, Haracska L.iScience. 2022 Mar 10;25(4):104053. doi: 10.1016/j.isci.2022.104053. eCollection 2022 Apr 15.PMID: 35355521
13. A Comprehensive Evaluation of the Performance of Prediction Algorithms on Clinically Relevant Missense Variants. Qorri E, Takács B, Gráf A, Enyedi MZ, Pintér L, Kiss E, Haracska L.Int J Mol Sci. 2022 Jul 19;23(14):7946. doi: 10.3390/ijms23147946.PMID: 35887294

tudományos tanácsadó

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

laboratóriumi ügyintéző

PhD hallgató

PhD hallgató

PhD hallgató

PhD hallgató

PhD hallgató

PhD hallgató

ügyvivő szakértő

ügyvivő szakértő
 HARACSKA Lajos
HARACSKA Lajos
|
tudományos tanácsadó | publikációk | CV |
 KISS Ernő
KISS Ernő
|
tudományos főmunkatárs | publikációk | CV |
 MÓROCZ Mónika
MÓROCZ Mónika
|
tudományos munkatárs | publikációk | CV |
 GRÁF Alexandra
GRÁF Alexandra
|
tudományos munkatárs | publikációk | CV |
 ÁDÁMNÉ TICK Gabriella
ÁDÁMNÉ TICK Gabriella
|
laboratóriumi ügyintéző | publikációk | |
 TAKÁCS Bertalan Vilmos
TAKÁCS Bertalan Vilmos
|
PhD hallgató | publikációk | CV |
 PEKKER Emese
PEKKER Emese
|
PhD hallgató | publikációk | CV |
 QORRI Erda
QORRI Erda
|
PhD hallgató | publikációk | CV |
 SÁNTA Ádám Tamás
SÁNTA Ádám Tamás
|
PhD hallgató | publikációk | CV |
 VARGA Valentin
VARGA Valentin
|
PhD hallgató | publikációk | CV |
 SHEMESH Sára
SHEMESH Sára
|
PhD hallgató | publikációk | CV |
 KOVÁCS Katalin
KOVÁCS Katalin
|
ügyvivő szakértő | ||
 VINCZE-KONTÁR Katalin
VINCZE-KONTÁR Katalin
|
ügyvivő szakértő | publikációk | CV |