
A legújabb technológiai fejlődések a rendszerbiológiában, a laboratóriumi automatizálásban és a nagy áteresztőképességű mikroszkópiában megnyitotta a kaput a komplex biológiai rendszerek szisztematikus felfedezéséhez nagy áteresztőképességű fénymikroszkóp alkalmazásával. A modern berendezések hatalmas mennyiségű adatot állítanak elő, amelyeket manuálisan nem lehet elemezni.
Az elemzési folyamat automatizálása számos kihívást vet fel a számítástechnikai sejtbiológiával kapcsolatban. Csoportunk elkötelezett a biológiai problémák számítástechnikai megoldásainak felkutatása mellett. Kutatásunk a biológia és az informatika metszéspontjára összpontosít, és ötvözi a laboratóriumi munkát és a fénymikroszkópiát képelemzéssel és a gépi tanulási módszerekkel.
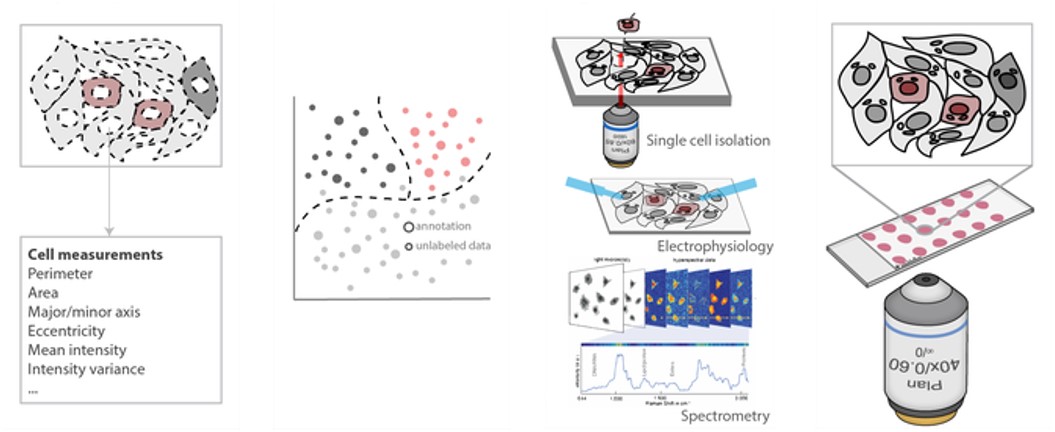
Kép analízis Gépi tanulás Egysejt analízis Képalkotás
Fényintenzitás javítás
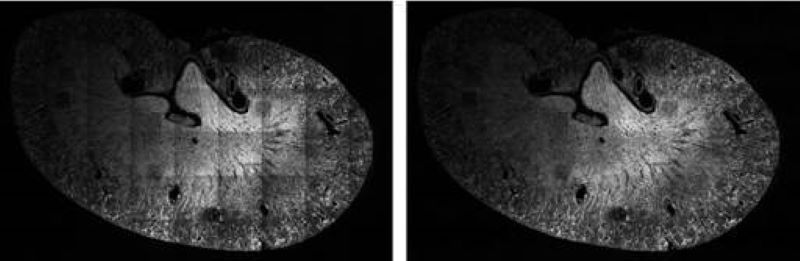
A fénymikroszkópos és különösen a fluoreszcens intenzitásokon alapuló kvantitatív mérésekhez elengedhetetlen a képadatok normalizálása az aberrációk korrigálása érdekében. Az egyik gyakori hibaforrás az objektív által létrehozott nem ideális megvilágítási mező. Az új algoritmusaink energia-minimalizálás segítségével kezelik ezen felmerülő problémákat. A korrigált mező rendkívül sima, és ezt a minőségi szintet kalibrált referencia minta nélkül is elérhetjük.
Rekonstruálás
Energiaminimalizáláson alapuló algoritmust fejlesztettünk ki a differenciális interferencia kontraszt (DIC) képek fázisképekké alakítására, hogy könnyebben elemezhessük őket.

Nyomon követés
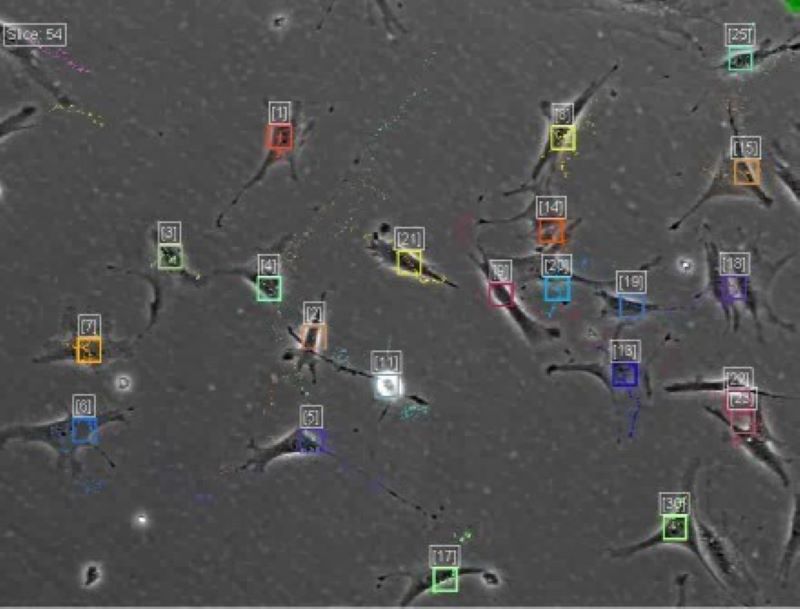
Olyan módszerek kidolgozása a célunk, amelyek az élő sejten, szövetmintán a sejtek vagy sejten belüli struktúrák azonosítására és nyomon követésére szolgálnak. Fejlesztettünk egy szoftvert, a CellTracker-t, amely kijavítja a megvilágítási problémákat, követi az elmozdulásokat, valamint automatikusan és manuálisan követi a sejteket, főleg fáziskontraszt képeken. A program a MATLAB GUI-val érhető el. [Download CellTracker]
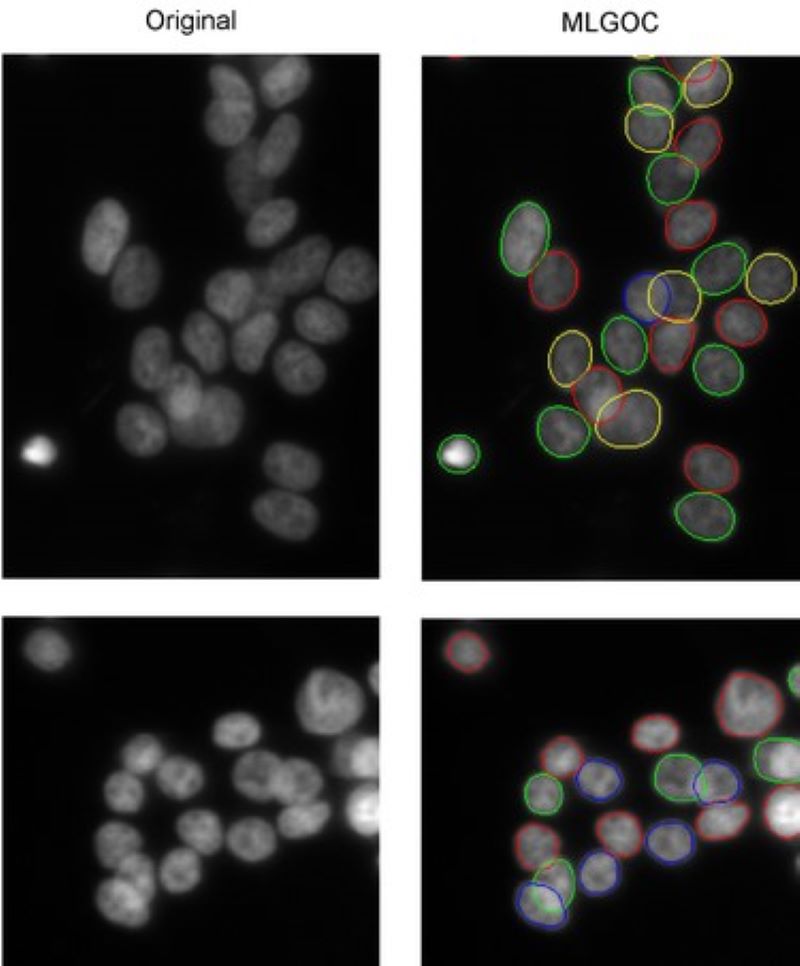
Átfedő sejtek szegmentálása (a 'gas of circles' modell)
Különböző módszerek az alakmodellezéshez a közel körkörös tárgyak (pl. sejtmagok) kiemelésére. A többrétegű 'gas of near-circles'” modell képes az egymással érintkező vagy akár átfedő sejtek szegmentálására nagyon összemosódó képeken is.
Szelektív aktív kontúrok
A szelektív aktív kontúrok egyszerű alakjellemzőket használnak, mint például területet és kerületet olyan objektumok leírására, amelyek alakzat alapján szegmentálnak és hatékonyan számolhatóak.
3D szelektív aktív kontúrok
A szelektív 2D aktív kontúrok 3D kiterjesztése.
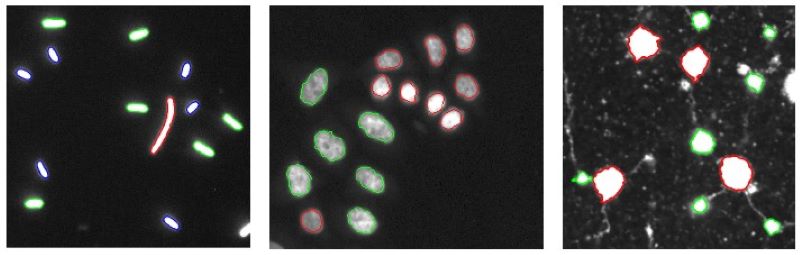
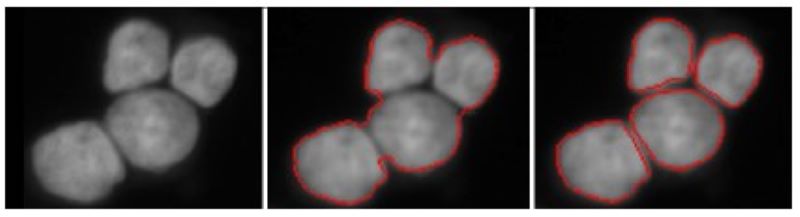
Érintkező sejtek szétválasztása
Szegmentálja az egyedi sejtmagokat az érintkező sejtek szétválasztásával. A kétlépcsős megközelítés az energiaminimalizálás egyszerű elvein alapszik és egy magasabb rendű aktív kontúr keretrendszert alkalmaz.
Fenotipizálás- Advanced Cell Classifier
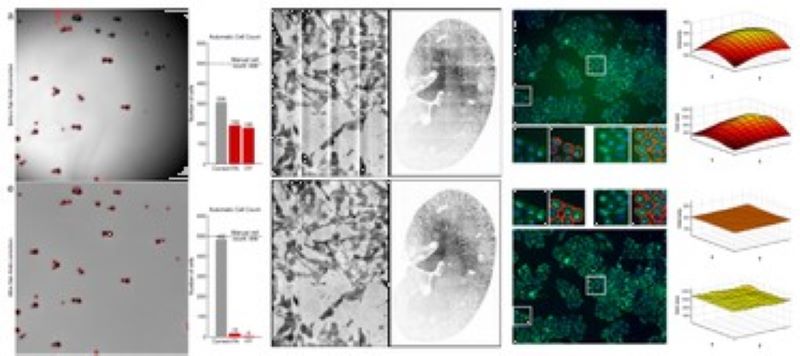
Advanced Cell Classifier egy gépi tanulási szoftver, amely a sejtalapú nagy felbontású képeket és szövetrész képeket értékeli a Szegedi Biológiai Kutatóközpont és a helsinki FIMM (korábban az ETH Zürichnél) fejlesztett ki. Az fő cél egy nagyon pontos elemzés, minimális felhasználói interakcióval, fejlett gépi tanulási módszerek alkalmazásával. Az egyik legelső nagyobb, teljes genom szintű RNAi elemzésre az ACC-t használták fel, és mindmáig több mint 300 000 000 kép feldolgozásában és több milliárd egysejt-alapú gépi tanulási döntés meghozatalában segített.
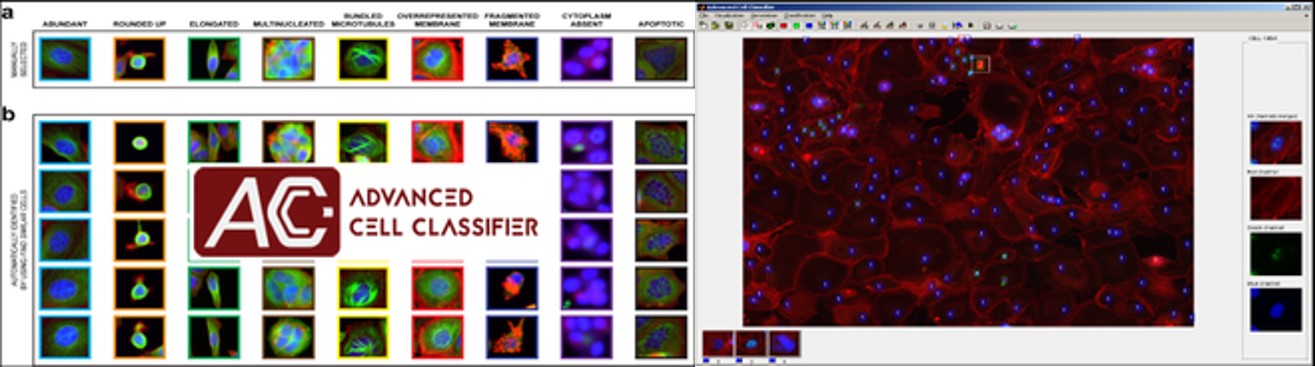
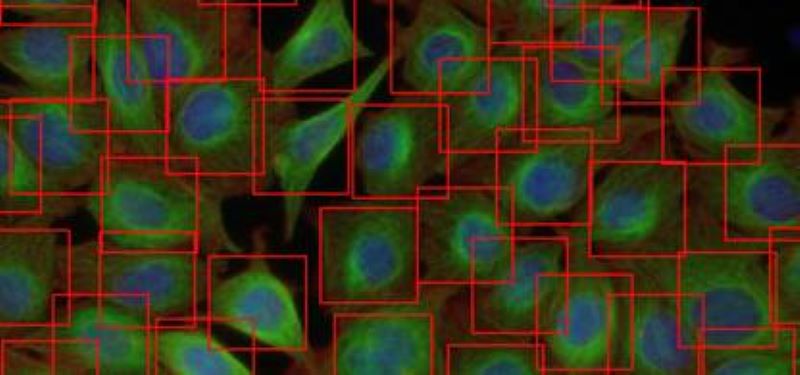
Mély tanulás (Deep Learning)
Kifejlesztettünk egy gyors és teljesen automatizált eszközt, amely a Deep Convolutional Neural Networks (DCNN) segítségével felméri a sejtek számát és elhelyezkedését. Módszereink nagyon felülmúlják a korszerű gépi tanulási modelleket, és összehasonlítható detektálási pontosságot biztosítanak a felhasználó szakértők számára.
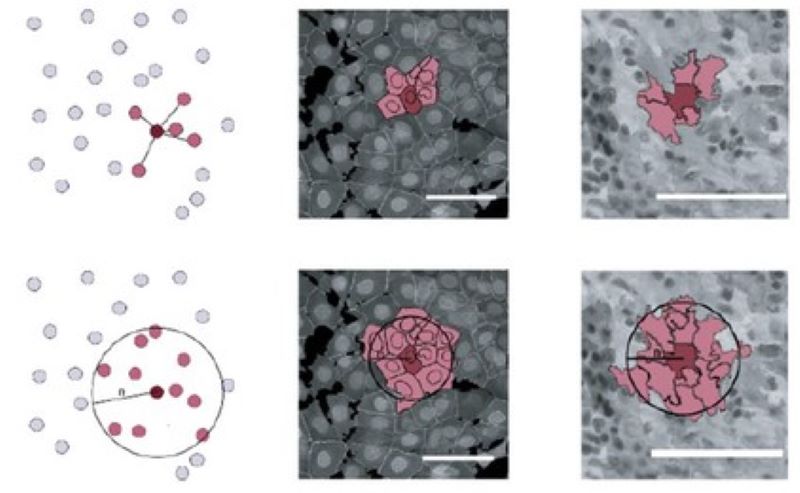
Mikrokörnyezet-alapú fenotipizálás
Megvizsgáljuk, hogy a különféle mikrokörnyezeti jellemzők hogyan járulnak hozzá egy sejt azonosításához, valamint hogyan javíthatják az ilyen környezeti információk az egysejtű fenotípusos képelemzést.
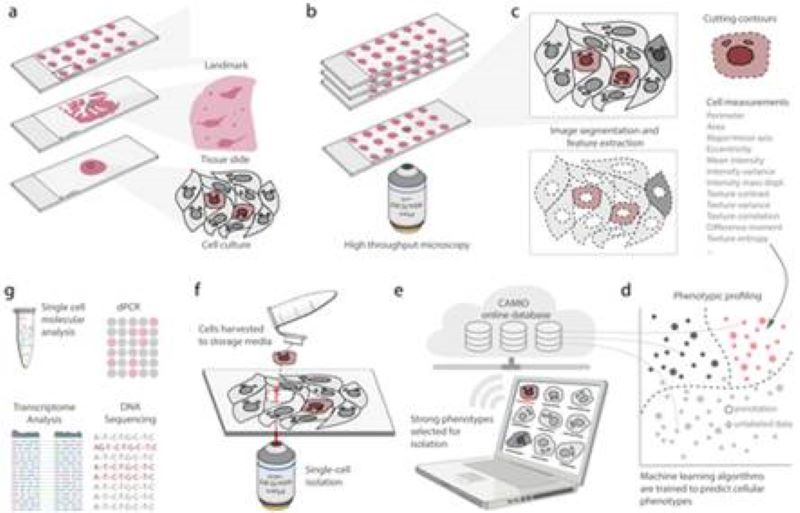
CAMI - A számítógép-asszisztált mikroszkópos izoláció
Kifejlesztünk egy nagy áteresztőképességű, roncsolásmentes és költséghatékony izolációs módszert, amely széles körben elérhető technikák használatával képes az egyedi célzott sejtet kiemelni a mintából. Nagyfelbontású mikroszkópia, mikrométeres pontosságú lézermikroszkópia, képelemzés és gépi tanulás használatával, ez a technológia lehetővé teszi a morfológia vagy hely alapján kiválasztott egyedi sejtek skálázható, molekuláris genetikai elemzését a mintán belül. A sejtek adatait, valamint az egyes sejtek helyét és kontúrját a CAMIO interaktív online adatbázisunkba küldjük.
AutoPatcher
Automatizált patch clamp rendszert építünk az idegsejtek elektrofiziológiai tulajdonságainak in vitro elemzésére. A rendszer automatikusan kiválaszt egy jelölő anyag nélküli sejtet és elvégzi rajta a mérést képfeldolgozás és a mély tanulás segítségével.

Mikroszkópia
Nagy áteresztőképességű vizsgálat
A HCS technológia különböző automatizált mikroszkópokat alkalmaz nagy áteresztőképességű formátumban, hogy kvantitatív információkat nyerjen ki sejtekből vagy szövetmintákból különböző paraméterek, például térbeli eloszlás vagy a célsejtek morfológiai változásai alapján. E különböző sejtes fenotípusok kezelésére mind a széles, mind a konfokális mikroszkópokat alkalmazzák a BIOMAG csoportban:
PerkinElmer Operetta
Főbb jellemzők:
Sejtek fenotípusának elemzése:

Leica SP8-digital light sheet

Lézeres mikrodisszekciós rendszerek
Az LMD során a lézer a szövetre fókuszál, és egy előre meghatározott útvonal mentén elvágja a mintát. A vágási folyamat után a szükséges elemeket el lehet távolítani és össze lehet gyűjteni további elemzés céljából. A kivágott anyag ezután rendelkezésre áll további downstream alkalmazásokhoz, például genomikához, transzkriptomikához, következő generációs szekvenáláshoz, proteomikához vagy más analitikai technikákhoz. A lézer mozgása és a mintagyűjtés alapján két fő megközelítést alkalmaznak:
Leica LMD6
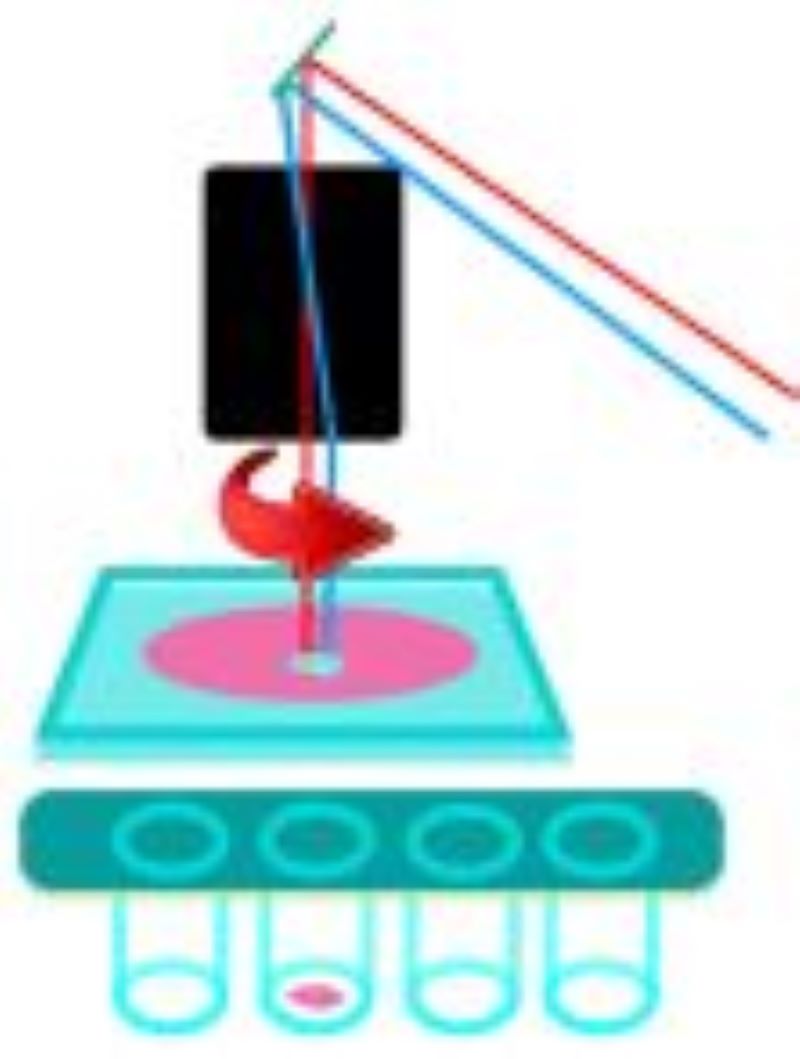
Zeiss Palm Microbeam

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munktárs

tudományos munktárs

tudományos munkatárs

tudományos segédmunkatárs

tudományos segédmunkatárs

tudományos müszaki ügyintéző

tudományos segédmunkatárs

tudományos müszaki ügyintéző

tudományos segédmunkatárs

PhD hallgató

ügyvivő szakértő

ügyvivő szakértő

ügyvivő szakértő

ügyvivő szakértő

laboráns
 HORVÁTH Péter
HORVÁTH Péter
|
tudományos főmunkatárs | publikációk | CV |
 BUZÁS Krisztina
BUZÁS Krisztina
|
tudományos munkatárs | publikációk | CV |
 MIGH Ede
MIGH Ede
|
tudományos munkatárs | publikációk | |
 CSAPÓNÉ MICZÁN Vivien
CSAPÓNÉ MICZÁN Vivien
|
tudományos munkatárs | publikaciók | CV |
 GYUKITY-SEBESTYÉN Edina
GYUKITY-SEBESTYÉN Edina
|
tudományos munktárs | publikációk | CV |
 HARMATI Mária
HARMATI Mária
|
tudományos munktárs | publikációk | CV |
 GRESKOVICS-DOBRA Gabriella
GRESKOVICS-DOBRA Gabriella
|
tudományos munkatárs | publikációk | CV |
 DIÓSDI Ákos
DIÓSDI Ákos
|
tudományos segédmunkatárs | publikációk | |
 GREXA István
GREXA István
|
tudományos segédmunkatárs | publikációk | |
 TASNÁDI Ervin Áron
TASNÁDI Ervin Áron
|
tudományos müszaki ügyintéző | publikációk | |
 PÁL Viktor
PÁL Viktor
|
tudományos segédmunkatárs | ||
 IVÁN Zsanett Zsófia
IVÁN Zsanett Zsófia
|
tudományos müszaki ügyintéző | ||
 BUKVA Mátyás
BUKVA Mátyás
|
tudományos segédmunkatárs | publikációk | CV |
 BÖRÖCZKY Timea
BÖRÖCZKY Timea
|
PhD hallgató | publikációk | CV |
 BAUER Dávid
BAUER Dávid
|
ügyvivő szakértő | ||
 KOVÁCS Ferenc
KOVÁCS Ferenc
|
ügyvivő szakértő | CV | |
 KRISTON András
KRISTON András
|
ügyvivő szakértő | publikációk | |
 PINTÉR Lilla
PINTÉR Lilla
|
ügyvivő szakértő | ||
 HAPEK Nóra
HAPEK Nóra
|
laboráns |