
A labor bemutatása
Az ezredforduló egyik nagy tudományos mérdföldköve az egyes organizmusok teljes genomszekvenciájának meghatározása volt. Az utóbbi másfél évtizedben az újgenerációs szekvenálási eljárások ezt a folymatot soha nem látott sebességre gyorsították. A számos elérhető genomszekvencia minimum három tudományág nagyléptékű fejlődését indította el: i) az evolúcióbiológiáét, ahol új fejezet nyílt a filogenetikai törzsfák felállításában; ii) a rendszerbiológiáét, ahol genomskálájú modellek építésével végre a teljes sejt működésének megértése is megcélozhatóvá vált; és iii) a molekuláris genetikáét, mivel a szekvenciák pontos ismerete azok precíz manipulációját is lehetővé tették. Laborunk a harmadik tudományág területére sorolható, de igyekszik támaszkodni az első kettő eredményeire is. Fő tevékenységünk olyan molekuláris genetikai eszközök fejlesztése és használata, melyekkel nemcsak jobban megismerhetővé válnak a mikrobiális sejtek, de precíz manipulációjuk is valóssággá válik. Utóbbi célja a biotechnológia és a szintetikus biológia területén hasznosítható baktériumtörzsek kifejlesztése.
Mobilis genetikai elemek: barátok vagy paraziták?
Kutatócsoportunk vezetője korábbi munkája során részt vett az Escherichia coli K-12 MG1655-ös baktériumtörzsben egy olyan nagyléptékű genommódosítás elvégzésében, melynek során minden mobilis genetikai elem eltávolításra került a genomból. Az így kapott multideléciós E. coli törzsből hiányoznak a profágok, a rekombinációs forrópontok, és a transzpozonok is. Ennek következtében nem csak a sejtek genetikai stabilitása nőtt szignifikánsan meg, de egy új transzpozon-mentes gazdasejtet is nyertünk, melyben bármely bevitt mobilis genetikai elem önmagában vizsgálható. Így lehetőségünk nyílt annak az evolúciós folyamatnak az újrajátszására, amely során az első transzpozon bejutott egy transzpozonmentes baktériumpopuláció egy sejtjébe. A kísérletek automatikus kiértékelését úgy tettük lehetővé, hogy eltérő fluoreszcens fehérjével jelöltük a transzpozon-mentes, és a transzpozon-tartalmú sejteket. Ez nagyszámú párhuzamos kompetíciós kísérlet elvégzését tette lehetővé. Kísérleteink bizonyították, hogy olyan környezetben, amelyben a transzpozon biztosítja az adaptív mutációt, a transzpozon fixálódik a populációban. Ha viszont egyéb mutátor sejtek is jelen vannak (és nagy populációkban ez a helyzet), azok kiszorítják a transzpozon-tartalmú sejtet. Összességében mindez arra utal, hogy a transzpozonok elterjedése inkább a genetikai sodródásnak és önmaguk replikációját kódoló képességüknek volt köszönhető, semmint a mutációs repertoárt kiszélesítő tulajdonságuknak.
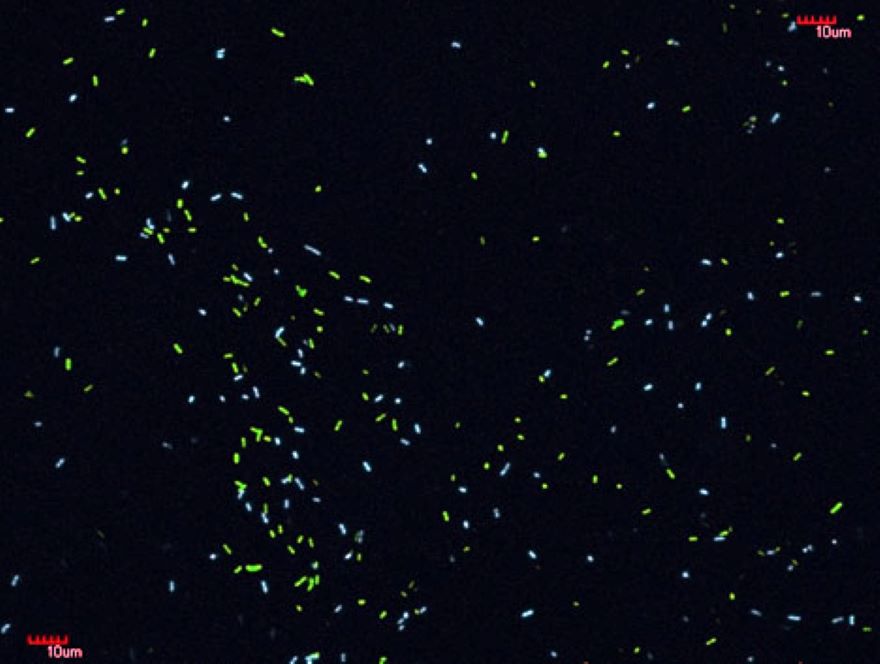
YFP-t és CFP-t expresszáló E. coli sejtek keveréke fluoreszcens fénymikroszkópban szemlélve (Fehér és mtsai., 2012 Mol Biol Evol)
Anyagcsere-mérnökség: anyagcsere-hálózatok újratervezése in vivo
Anyagcsere-mérnökség alatt általában élő sejtek anyagcsere-hálózatának átprogramozását értjük, kijelölt vegyületek termelése, lebontása vagy átalakítása céljából. Csoportunk leginkább új genetikai módszerek kidolgozásában érdekelt, melyekkel egyszerűsíthetjük az anyagcsere-mérnökség kísérletes lépéseit. A munkafolyamat több lépését is megcélozzuk: exogén gének módosítása, gének és operonok klónozása, génexpresszió-szabályozás, diverzitás-növelés, szelekció, szűrés, genetikai változékonyság modulációja, stb. Korábbi, egy számítógépes reakció-útvonal tervező eljárás kísérletes tesztelésében szerzett tapasztalatunkat latba téve igyekszünk új típusú, értékes bioaktív vegyületeket bakteriális sejtek genetikai módosításával olcsón előállítani.
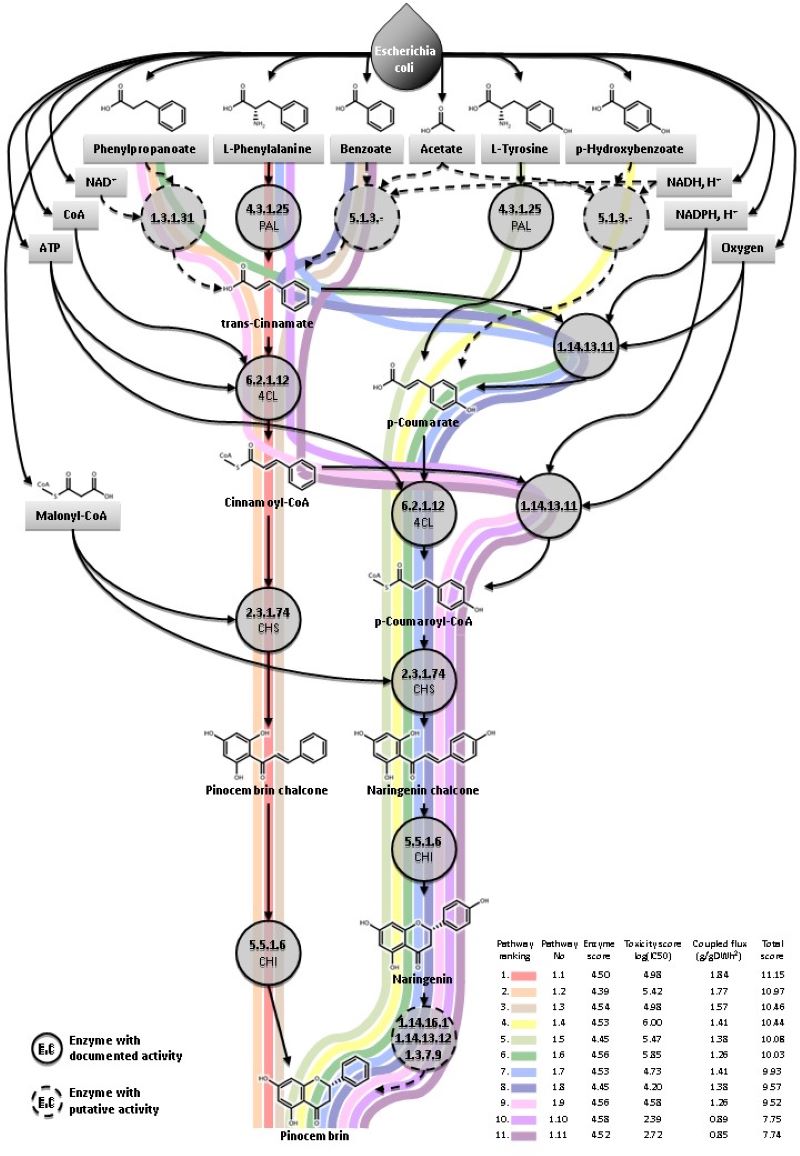
Az E. coli endogén vegyületeiből kiinduló, potenciális pinocembrin-termelő biokémiai útvonalak (Fehér és mtsai., 2014 Biotech J.)
Transzpozon-csendesítés
Csoportunk egyes tagjai már hosszabb ideje foglalkoznak a baktériumsejtek genetikai stabilitásának növelésével. Az egyik első ilyen munkánk az Escherichia coli K-12 MG1655 törzs transzpozonjainak eltávolítása volt (Pósfai et al., 2006). Később hozzájárultunk egy hasonló munkához a fehérjetermelésről híres E. coli BL21(DE3) törzsben is. E projektek azonban mind igen hosszadalmasok voltak, több évet vettek igénybe. Hogy felgyorsítsuk a folyamatot, négy bakteriális inszerciós szekvencia (IS) ugrási gyakoriságát nem azok génjeinek törlésével, hanem expressziójuk gátlásával kíséreltük meg lecsökkenteni. Ehhez a CRISPR/Cas rendszer olyan változatát használtuk, mely kötődik a cél DNS-hez, de azt nem vágja el. Ilyen inaktivált Cas (dCas) alkalmazásával demonstráltuk négy IS típus (IS1, IS3, IS5 és IS150) ugrási gayakoriságának drasztikus csökkenését mind kromoszómális, mind plazmid célpontokra. Genomi-skálájú RNS-szekvelással kimutattuk, hogy a csökkenés hátterében általában az IS-ek transzpozázának csökkent expressziója áll, de a végálló ismétlődések sztérikus akadályozása is feltehetően szerepet játszik az ugrások gátlásában. Rendszerünk portábilis voltát annak többféle E. coli törzsben való alkalmazásával bizonyítottuk. Tudtunkkal ez az első olyan rendszer, mellyel egyszerre négy IS-elem transzpozíciója gátolható, in vivo (Nyerges et al., 2019).
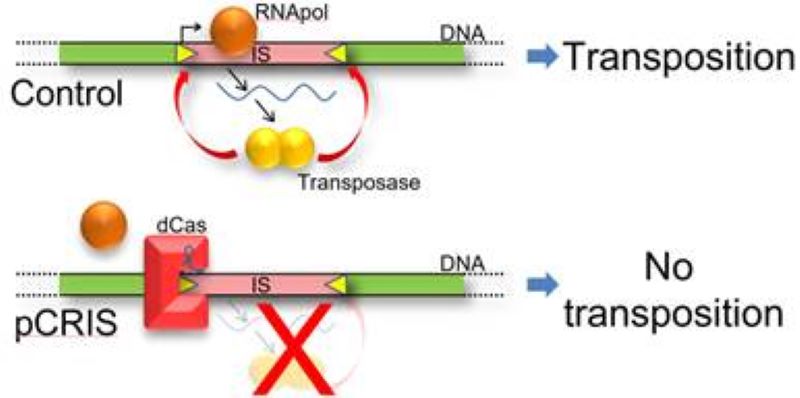
A CRISPR/dCas-mediált transzpozon-csendesítés mechanizmusa (Nyerges és mtsai., 20`18 Synth Biol)
Egy örökletes, súlyos rövidlátás-betegség genetikai térképezése
Csoportunkat nem csak a bakteriális genetika érdekli, nyitottak vagyunk más területeken is tudományos együttműködésre. Erre példa annak a családnak a vizsgálata, melyben kizárólag a nőkben fordult elő súlyos, progresszív miópia (rövidlátás). A családfa vizsgálatával deklaráltuk a hordozó férfiakat, és észleltük, hogy a hordozó férfiak női utódjai kivétel nélkül betegek. Ezzel szemben a beteg nők lányutódjai kevertek: lehetnek egészségesek és betegek is. Ezek alapján feltételeztük, hogy X-hez kötött, domináns, nőkre korlátozódó öröklődéssel álluk szemben. A Seqomics Biotechnology Kft. segítségével két családtagon teljes-exom szekvenálást végeztünk, mivel a monogénesen öröklődő kórképeket gyakran a kódoló régiót érintő mutációk okozzák. Az SzTE Klinikai Genetikai Laboratóriuma a nyers szekvenciák analízise során nonszensz mutációt talált az X kromoszóma ARR3 génjében, mely jelenléte tökéletesen szegregált a betegséggel mind a 18 vizsgált nőnemű családtagban. Ez az ARR3 gén mutációja okozta betegség első példája európai családban. Jelenleg a mutáció és a fenotípus kapcsolatának molekuláris magyarázatán dolgozunk.
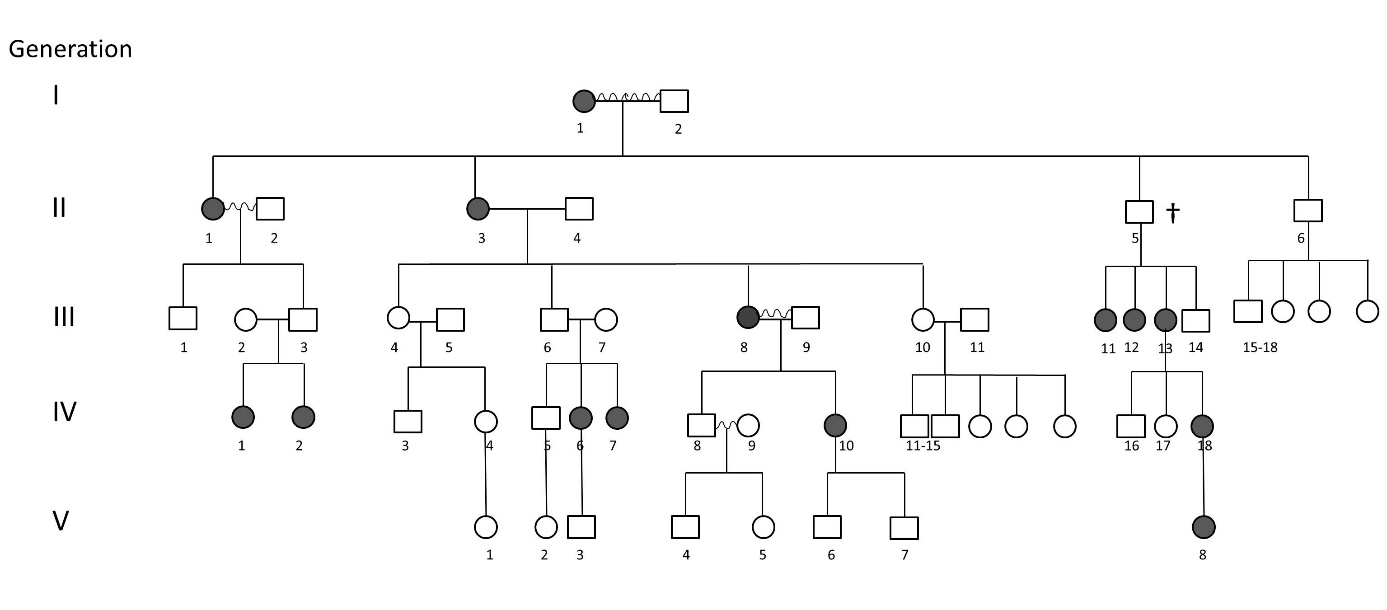
Egy nőkre-korlátozódó, súlyos fokú rövidlátás-betegség családi halmozódása


tudományos főmunkatárs

tudományos főmunkatárs

PhD hallgató

PhD hallgató

PhD hallgató
 FEHÉR Tamás
FEHÉR Tamás
|
tudományos főmunkatárs | publikációk | CV |
 ÖTVÖS Ferenc
ÖTVÖS Ferenc
|
tudományos főmunkatárs | publikációk | CV |
 AVRAMUCZ Ákos
AVRAMUCZ Ákos
|
PhD hallgató | publikációk | CV |
 VARGA Zsuzsanna Katalin
VARGA Zsuzsanna Katalin
|
PhD hallgató | CV | |
 GOMBOS Dávid
GOMBOS Dávid
|
PhD hallgató | publikációk | CV |