
A neurovaszkuláris egység – amelynek legfontosabb alkotóelemei az egymással folyamatos szoros kapcsolatok által összekötött agyi endotélsejtek, a periciták és az asztrociták – kulcsszerepet játszik a központi idegrendszer homeosztázisának fenntartásában.
A neurovaszkuláris egység két legfontosabb szerepe egy funkcionálisan aktív határfelületet képzése a keringés és a központi idegrendszer között, ami a vér-agy gát, illetve a vérellátás biztosítása az idegi aktivitás kívánalmainak megfelelően (neurovaszkuláris kapcsolás).
A neurovaszkuláris egységnek kiemelt jelentősége van a klinikai gyakorlatban is. Egyrészt szerepet játszik számos idegrendszeri megbetegedés patogenézisében, mint a stroke, agyi traumák, tumorok, neurodegeneratív megbetegedések, és kiemelt jelentősége van az öregedéssel kapcsolatos folyamatokban is. Másrészt az agyi erek relatív impermeabilitásának köszönhetően számos gyógyszer nem tud terápiás koncentrációt elérni a központi idegrendszerben, aminek következtében a vér-agy gát az idegrendszeri megbetegedések terápiájának egyik legjelentősebb akadályát képezi.
Csoportunk kutatásainak célja a neurovaszkuláris egység fiziológiás és patológiás körülmények közötti működésének molekuláris szintű feltárása. Különböző in vitro vér-agy gát modelleket és in vivo rendszereket használva tanulmányozzuk a neurovaszkuláris egység szerepét öregedéssel kapcsolatos folyamatokban és az agyi áttétképzésben.
In vitro modellrendszerek
Annak érdekében, hogy közvetlenül tudjuk vizsgálni a neurovaszkuláris egység működését szabályozó molekuláris mechanizmusokat, in vitro modellt használunk, amely az agyi endotélsejtek mellett periciták és asztrociták tenyésztésén alapul. Ez a modell hasznos eszköz úgy az alapkutatás, mint az alkalmazott kutatás számára, és alkalmas a gyógyszerek vér-agy gáton való átjutásának tanulmányozására.
Metodikai palettánkból megemlíthetőek különböző biokémiai és molekuláris módszerek, immunofluoreszcens technikák és a barrier tulajdonságok mérésére alkalmas funkcionális tesztek.
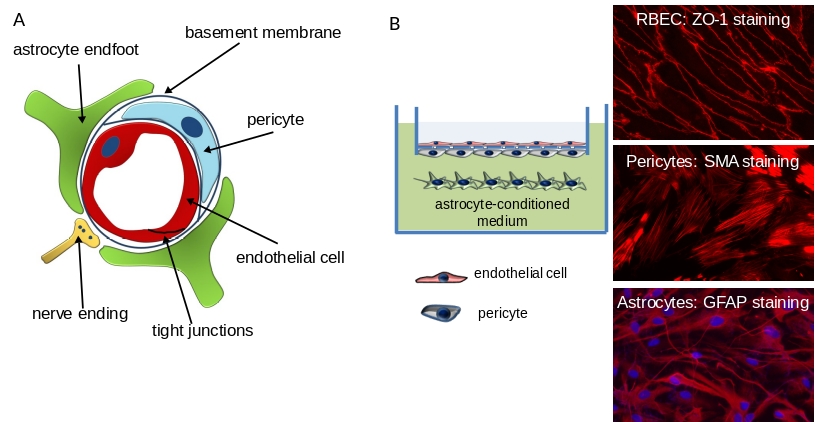
1. ábra. A: A neurovaszkuláris egység sejtes szerkezete. B: A vér-agy gát in vitro modellje
In vivo modellek és modern mikroszkópos technikák
In vivo vizsgálataink során két-foton mikroszkópot és transzgenikus egereket használunk annak érdekében, hogy nyomon kövessük a neurovaszkuláris egység morfológiai és funkcionális sajátosságait fiziológiás és patológiás körülmények között. Emellett szuperrezolúciós mikroszkóp (STED) teszi lehetővé a szubmikroszkopikus változások tanulmányozását.
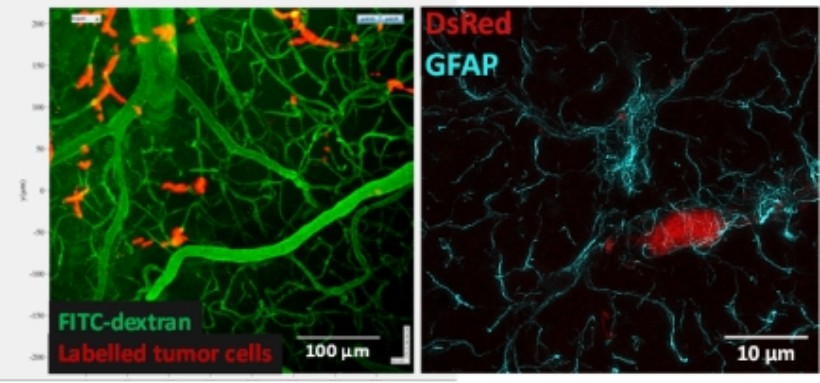
2. ábra. A: Két-foton mikroszópos felvétel egy élő állat agyából. B: Asztrociták (cián) és periciták (piros) STED mikroszkópos képe
A neurovaszkuláris egység szerepe gyulladásos és öregedéshez társuló folyamatokban
A gyulladás gyakori velejárója olyan fiziológiás vagy kóros idegrendszeri folyamatoknak, mint az agyi iszkémia, traumák, tumorok, neurodegeneratív megbetegedések vagy az öregedés. Vizsgálataink a mintázat felismerő receptorokra és az inflammaszóma aktivációra irányulnak. A periciták kulcsszerepet játszhatnak gyulladásos és öregedéshez társuló folyamatokban, ezért különös figyelmet fordítunk e sejtek működésének és kontraktilitásának in vivo és in vitro tanulmányozására.
Az agyi kapillárisok különösen érintettek az öregedés során, azonban az endotélium regenerációs képessége erősen korlátozott. Ezért vizsgáljuk az endoteliális prekurzor sejtek terápiás potenciálját öregedéssel kapcsolatos kapilláris és cerebrális diszfunkciókban.
A metasztatikus sejtek és a NVE interakciói
A vér-agy gát által alkotott barrier ellenére az áttétes agyi daganatok – amelyek elsősorban tüdőrák, emlőrák és melanóma eredetűek – sokkal gyakoribbak mint a primér agydaganatok. Az agyi mikrokörnyezet nagyon kedvezőtlen lehet a metasztatikus sejtek számára, azonban azok a tumoraganatsejtek, amelyek alkalmazkodni tudnak a sajátos körülményekhez, kihasználhatnak olyan előnyöket, mint a gazdag vérellátás vagy az immunrendszerrel és a gyógyszerekkel szembeni relatív védettség.
A kutatásaink során azokat az endotélsejtekkel, gliasejtekkel és pericitákkal kapcsolatos mechanizmusokat vizsgáljuk, amelyek szerepet játszanak a metasztázisok kialakulásának két kulcslépésében: a daganatsejtek átjutásában a vér-agy gáton és kezdeti túlélésében az agyi mikrokörnyezetben. Célunk a metasztaikus sejtek és a neurovaszkuláris egység sejtjei közötti kommunikáció megértése, ami elengedhetetlen új prevenciós és terápiás stratégiák azonosításához.
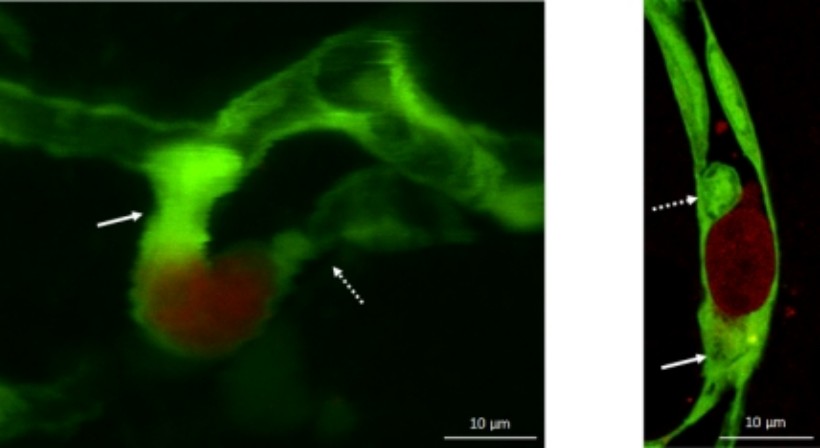
3. ábra. Metasztatikus sejtek (piros) a transzmigráció kezdeti fázisában (zöld: endotélsejtek). A: két-foton mikroszkópos kép, B: konfokális mikroszkópos kép. A nyilak kapilláris összehúzódásra és endotelialis dugókra mutatnak.
-Ádám Mészáros*, Kinga Molnár*, Csilla Fazakas, Bernát Nógrádi, Adél Lüvi, Tamás Dudás, László Tiszlavicz, Attila Elek Farkas, István Adorján Krizbai#, Imola Wilhelm#. Inflammasome activation in peritumoral astrocytes is a key player in breast cancer brain metastasis development. Acta Neuropathol Commun. 2023 Sep 25;11(1):155. doi: 10.1186/s40478-023-01646-2. (IF2022: 7,1). D1*első szerzők, #levelező szerzők
-Molnár K*, Nógrádi B,*, Kristóf R, Mészáros Á, Pajer K, Siklós L, Nógrádi A, Wilhelm I# and Krizbai IA# Motoneuronal inflammasome activation triggers excessive neuroinflammation and impedes regeneration after sciatic nerve injury. J Neuroinflammation. 2022 Mar 19;19(1):68. doi: 10.1186/s12974-022-02427-9. (IF2022: 9,3) D1. *első szerzők, #levelező szerzők
-Menyhárt Á, Frank R, Farkas AE, Süle Z, Varga VÉ, Nyúl-Tóth Á, Meiller A, Ivánkovits-Kiss O, Lemale CL, Szabó Í, Tóth R, Zölei-Szénási D, Woitzik J, Marinesco S, Krizbai IA, Bari F, Dreier JP, Farkas E. Malignant astrocyte swelling and impaired glutamate clearance drive the expansion of injurious spreading depolarization foci. J Cereb Blood Flow Metab. 2022 Apr;42(4):584-599. doi: 10.1177/0271678X211040056. (IF2022: 6,3) D1
-Molnár K, Mészáros Á, Fazakas C, Kozma M, Győri F, Reisz Z, Tiszlavicz L, Farkas AE, Nyúl-Tóth Á, Haskó J, Krizbai IA*, Wilhelm I*. Pericyte-secreted IGF2 promotes breast cancer brain metastasis formation. Mol Oncol. 2020 Sep;14(9):2040-2057. doi: 10.1002/1878-0261.12752. (IF2020: 6,603). D1. *levelező szerzők
-Haskó J, Fazakas C, Molnár K, Mészáros Á, Patai R, Szabó G, Erdélyi F, Nyúl-Tóth Á, Győri F, Kozma M, Farkas AE, Krizbai IA*, Wilhelm I*. Response of the neurovascular unit to brain metastatic breast cancer cells. Acta Neuropathol Commun. 2019 Aug 19;7(1):133. doi: 10.1186/s40478-019-0788-1 (IF2019: 6.270). D1. *levelező szerzők
-Hildegard Herman, Csilla Fazakas, János Haskó, Kinga Molnár, Ádám Mészáros, Ádám Nyúl-Tóth, Gábor Szabó, Ferenc Erdélyi, Aurel Ardelean, *Anca Hermenean, *István A. Krizbai, *Imola Wilhelm. Paracellular and transcellular migration of metastatic cells through the cerebral endothelium. J Cell Mol Med. 2019 Apr;23(4):2619-2631. doi: 10.1111/jcmm.14156 (IF2019: 4,486). Q1. *levelező szerzők
-Costea L, Mészáros Á, Bauer H, Bauer HC, Traweger A, Wilhelm I, Farkas AE*, Krizbai IA*. The Blood-Brain Barrier and Its Intercellular Junctions in Age-Related Brain Disorders. Int J Mol Sci. 2019 Nov 3;20(21):5472. doi: 10.3390/ijms20215472. (IF2019: 4,556). Q1. *levelező szerzők
-Wilhelm I, Fazakas C, Molnár K, Végh AG, Haskó J, Krizbai IA. Foe or friend? Janus-faces of the neurovascular unit in the formation of brain metastases. J Cereb Blood Flow Metab. 2018 Apr;38(4):563-587. doi: 10.1177/0271678X17732025. (IF2018: 6,040). D1.
-Menyhárt Á*, Farkas AE*, Varga DP, Frank R, Tóth R, Bálint AR, Makra P, Dreier JP, Bari F, Krizbai IA, Farkas E. Large-conductance Ca2+-activated potassium channels are potently involved in the inverse neurovascular response to spreading depolarization. Neurobiol Dis. 2018 Nov;119:41-52. doi: 10.1016/j.nbd.2018.07.026 (IF2018: 5,160). D1. *első szerzők
-Nyúl-Tóth Á, Kozma M, Nagyőszi P, Nagy K, Fazakas C, Haskó J, Molnár K, Farkas AE, Végh AG, Váró G, Galajda P, Wilhelm I, Krizbai IA. Expression of pattern recognition receptors and activation of the non-canonical inflammasome pathway in brain pericytes. Brain Behav Immun. 2017 Aug;64:220-231. doi: 10.1016/j.bbi.2017.04.010. (IF2017: 6,306). D1

tudományos tanácsadó

tudományos főmunkatárs

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos segédmunkatárs

tudományos segédmunkatárs

PhD hallgató

PhD hallgató

PhD hallgató

Szent-Györgyi diák

Szent-Györgyi diák
 KRIZBAI István
KRIZBAI István
|
tudományos tanácsadó | publikációk | CV |
 WILHELM Imola
WILHELM Imola
|
tudományos főmunkatárs | publikációk | CV |
 FARKAS Attila
FARKAS Attila
|
tudományos főmunkatárs | publikációk | CV |
 FAZAKAS Csilla
FAZAKAS Csilla
|
tudományos munkatárs | publikációk | CV |
 NYÚL-TÓTH Ádám
NYÚL-TÓTH Ádám
|
tudományos munkatárs | publikációk | CV |
 HASKÓ János
HASKÓ János
|
tudományos munkatárs | publikációk | CV |
 KRECSMARIK Mónika
KRECSMARIK Mónika
|
tudományos munkatárs | publikációk | CV |
 GYŐRI Fanni
GYŐRI Fanni
|
tudományos segédmunkatárs | publikációk | CV |
 DUDÁS Tamás
DUDÁS Tamás
|
tudományos segédmunkatárs | publikációk | CV |
 Tejal SHREEYA
Tejal SHREEYA
|
PhD hallgató | publikációk | |
 Maryam NAEEM
Maryam NAEEM
|
PhD hallgató | ||
 NAGY Valentina
NAGY Valentina
|
PhD hallgató | publikációk | CV |
 LÜVI Adél
LÜVI Adél
|
Szent-Györgyi diák | CV | |
 TÓTH István
TÓTH István
|
Szent-Györgyi diák | CV |