
Biomembránokhoz kapcsolódó orvosbiológiai vonatkozású életfolyamatok molekuláris biofizikai megközelítése
Unikális, spektroszkópián alapuló molekuláris biofizikai megközelítésünk funkcionálisan releváns adatokat szolgáltat a kiválasztott membrán-fehé rje rendszerek felépítéséről és dinamikájáról. A legtöbb saját és együttműködéses témánk erősen orvosbiológiai vonatkozású. Lokalizált és tranziens spektroszkópiával hangolunk rá a natív molekuláris események térbeli elhelyezkedésére és időablakára a biomembránokban és membránhoz kötött fehérjékben. Ezért adataink funkcionálisan teljes mértékben relevánsak. A kísérleti molekuláris adatoknak molekulamechanikai módszerekkel és mesterséges intelligenciával (AI) való kombinációja nagyon ígéretes, és lehetővé teszi, hogy felépítsük natív biomolekulák atomi és fizikai modelljeit, és leírjuk azok hatásmechanizmusát. Fő technikánk a (helyspecifikus) spin-jelző és a spin-csapdázó elektron paramágneses rezonancia (EPR) spektroszkópia (Közép- és Kelet-Európában a legjobb X-sávos folyamatos hullámú és impulzus EPR spektrométerünk van). Fluoreszcencia és Fourier-transzformációs infravörös spektroszkópiát használunk a natív vagy mesterségesen bevitt fluoreszcens molekulacsoportok ill. molekuláris rezgések tanulmányozására biomolekulákban. Ezeket a technikákat reakciót elindító módszerekkel kombináljuk és így reakciókinetikát is tudunk mérni. A fázisátmeneteket differenciál pásztázó kaloriméterünkkel tanulmányozzuk. Az elméleti munkához számítógépes klaszterünk is rendelkezésre áll. Megközelítésünk lényegében funkcionális szerkezetbiológia, amelyet számos együttműködésben alkalmazunk a szabadgyökök, modell- és biomembránok, lipid alapú drug-delivery formulák, sejttenyészetek, oldható és membránfehérjék és élelmiszertermékek tanulmányozására.
Aktív doktori témáink két doktori iskolában vannak. Külföldi hallgatókat arra biztatunk, hogy pályázzanak a Stipendium Hungarica ösztöndíjra, hogy ezeken a témákon doktori munkát végezhessenek. Kutatásainkat népszerűsítő információs csatornánk a youtube-on található.
Membrán-kötött fehérjék az eukariota sejtek sejtszerveinek pH szabályozásában és membránfúziós folyamataiban
Az eukarióta sejtszervek membránfúziós lépéseinek és pH-szabályozásának molekuláris mechanizmusai számos normális és patogén fiziológiai sejtfolyamat szempontjából nagy jelentőséggel bírnak. Ezekben a folyamatokban a kulcsfontosságú fehérjék 3 osztályára összpontosítunk: a vakuoláris proton-ATPáz (V-ATPáz), a “ductin” és a szintaxin fehérjékre. Az előbbi kettő a saját projektünk, és szorosan kapcsolódnak egymáshoz, mivel a V-ATPáz egy része a ductin családhoz tartozik. A ductin és a szintaxin fehérjék fontos szerepet játszanak a vezikulák fúziós mechanizmusaiban. Néhány ductin fehérje sejtek közötti rés-csomópontként és szinaptikus mediatofórként működik. Korábban meghatároztuk az egyik gap-junction ductin fehérje membránbeli helyzetét és lipidekkel való kölcsönhatását. A Drosophila Autophagy Lendület csoporttal (Juhász G., Genetikai Intézet) együttműködve pedig tanulmányozzuk a szintaxinok membránokhoz való kötődését és kölcsönhatásukat a V-ATPázzal. Az eukarióta sejtek belső szervei savasabb kémhatásúak, mint a citoplazma. A savasodásukért felelős fehérjekomplexum a természet leguniverzálisabb protonpumpája, a vakuoláris proton-ATPáz. A V-ATPáz membránfúziós folyamatokban is részt vesz azáltal, hogy szabályozott helyi savasítást biztosít a sejtek bizonyos régióiban. A V-ATPáz számos betegségben kritikus szerepet játszik, és szövetspecifikus gátlása kulcsfontosságú terápiás cél. Mérete és összetettsége miatt fehérjekomplex szerkezet-funkció kapcsolat részleteinek megértése napjainkban a biofizika és a molekuláris biológia egyik legnagyobb kihívása. A V-ATPáz egy membránhoz kötött molekuláris rotormotor (1. ábra), amely az ATP hidrolíziséből nyert kémiai energiát a rotor doménjének forgatásává alakítja át meghatározott alegységek közötti forgatónyomaték előállításával. Ez transzmembrán proton szállításhoz vezet az állórész és a rotor domén közötti határfelületen. V-ATPáz-vizsgálataink célja az alegység-alegység és az alegység-lipid kölcsönhatások, a szintetikus inhibitorok és kétértékű kationok hatása a funkcióra és az alegység összeállítására, valamint a rotációs mechanizmus részleteinek feltárása. Nemrégiben megmértük a rotor forgási sebességét élesztő vakuoláris membrán vezikulákban. Elsőként publikáltuk a rotációs sebességet egy olyan V-ATPázban, amely nincs kitéve genetikai vagy kémiai módosításnak, és nincs rögzítve szilárd hordozóhoz. Azt is felfedeztük, hogy a V-ATPáz aktivitása befolyásolható oszcilláló transzmembrán elektromos térrel. Az elektromos térhatásokat a forgó mechanizmus további részleteinek feltárására használjuk. Rekonstruált modell membránban a c-gyűrű (vagyis a V-ATPáz ductin részének) funkcionális összeszerelődését tanulmányozzuk.
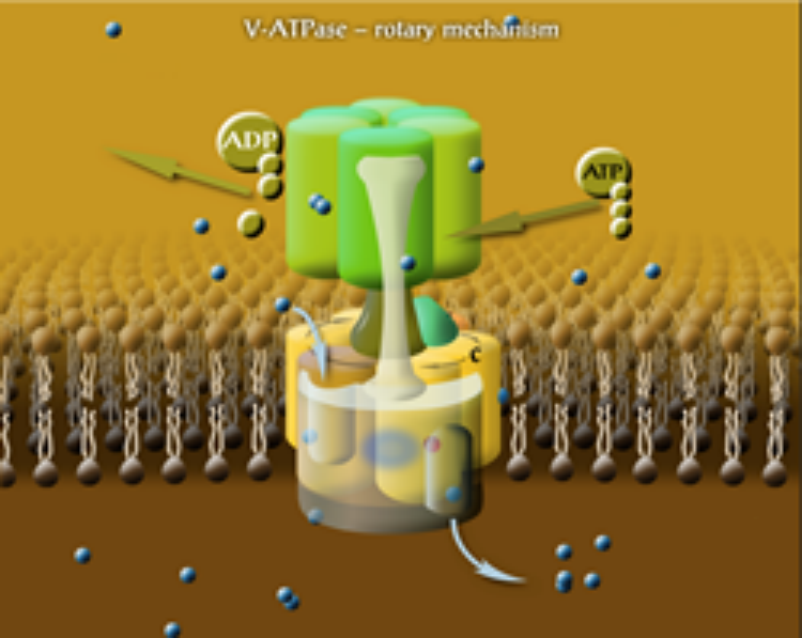
1. ábra. A V-ATPáz forgó mechanizmusa. Mindegyik c alegységhez kötődik proton, amikor azok lipidekke érintkeznek. A protonok a c és a alegységek közötti hidrofil zsákokon keresztül érkeznek és távoznak a kötőhelyükről.
Mesterséges intelligencia és molekulamechanikai megközelítés membránfehérjék szerkezetbiológiájában
A membránfehérjék klasszikus szerkezeti biológiáját erősen korlátozza a fehérjék izolálásának és a natívtól eltérő környezetben való szolubilizálásának vagy kristályosításának szükségessége. Ezért nem meglepő, hogy a több, mint 100 ezer ismert fehérjeszerkezet között csak néhány száz transzmembrán membránfehérje van, miközben az emberi genomban lévő gének nagyjából 30%-a kódol membránfehérjéket, és a gyógyszerek több, mint 50%-a membránfehérjéket céloz meg. Továbbá mindig felmerül a kérdés: az izolált membránfehérjék mesterséges környezetben mért térszerkezete és tulajdonságai mennyiben korrelálnak a natív, membránon belüli viszonyokkal? Ezen okok miatt az elméleti megközelítéseknek óriási jelentőségük van. A 2. ábra a szerkezetbiológia alapvető és legnagyobb kihívást jelentő problémájának lényegét mutatja: ha ismerjük egy fehérje szekvenciáját, hogyan lehet megjósolni annak szerkezetét? Mivel a membránfehérje natív konformációja natív közvetlen határfelületet feltételez, a 2. ábrán bemutatott szekvencia-szerkezet kódolás csak a natív membránkörnyezetben érvényes. Ezért megközelítésünk lényege a membránfehérjékről strukturális adatok mérése, mégpedig funkcionális, natív környezetükben, és az így kapott adatok elméleti módszerekkel történő kombinálása a háromdimenziós szerkezet megjóslásához. Jó példa erre a citokróm b561 membránfehérje-család konzervált négy hélix transzmembrán kötegének alapvető vázszerkezetének korábbi predikciója: több, mint két évtizedes, a család bármely fehérjéjének kikristályosítását célzó sikertelen erőfeszítések után is kb. 10 évig csak az általunk publikált szerkezetek voltak elérhetőek. A múltban "manuálisan" modelleztük a citokróm c membránbeli helyzetét, saját membránrekonstrukciós távolság méréseink alapján. Meghatároztuk továbbá az M13 bakteriofág fő burokfehérjéjének azon vázszerkezeteit, amelyek a legkompatibilisebbek a membránokban mért szerkezeti adatokkal. A jelen projekt fő célja a meglévő fehérje-szerkezet predikciós technikák továbbfejlesztése a membránfehérjékre összpontosítva. A következő útvonal mentén haladunk: neuronhálós (AI) módszereket alkalmazunk és finomítunk az alacsony felbontású strukturális jellemzők előrejelzésére egy ismeretlen szerkezetű fehérje szekvenciájából. A jelenlegi teszt fázisban vizsgálatainkat homológ membránfehérjékre korlátozzuk. A megjósolt szerkezeti jellemzőket mechanikai korlátokká (virtuális potenciálokká) alakítjuk, és alacsony térbeli felbontású konformációs keresésben alkalmazzuk. A legkisebb virtuális szabad energiájú struktúrákat kiválasztjuk, majd azokat tovább optimalizájuk, minden atomot figyelembe vevő molekuláris mechanikai szimulációkban. Ezekben a szimulációkban már a kísérleti szerkezeti adatokat is figyelembe vesszük.
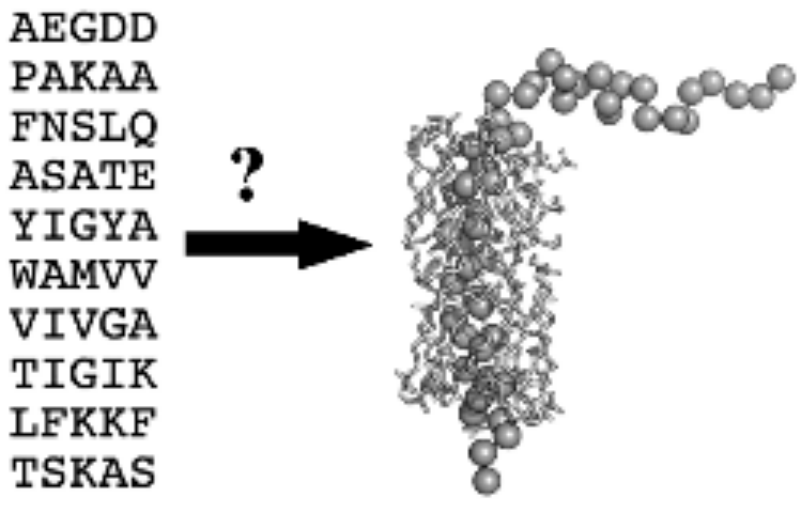
2. ábra. Az M13-as bakteriofág fő burokfehérje szekvenciája és 3-dimenziós gombolyag szerkezete, a szolvatációs, első réteg lipidekkel együtt.

tudományos tanácsadó

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

laboráns
 PÁLI Tibor
PÁLI Tibor
|
tudományos tanácsadó | publikációk | CV |
 SEBŐKNÉ NAGY Krisztina
SEBŐKNÉ NAGY Krisztina
|
tudományos munkatárs | publikációk | CV |
 KOTO Teruaki
KOTO Teruaki
|
tudományos munkatárs | publikációk | CV |
 KÓTA Zoltán
KÓTA Zoltán
|
tudományos munkatárs | publikációk | CV |
 BARTA Csilla
BARTA Csilla
|
laboráns |