Nanobioszenzorika Csoport
Kutatási témák
A sejtadhézió számos biológiai folyamatban fontos szerepet tölt be. Ezek közé tartozik a szövetek kialakítása, a sejtek közötti kommunikáció, valamint a sejtmozgás. Az adhézió létrejöhet sejt-sejt vagy sejt-extracelluláris mátrix közötti kölcsönhatások által, a sejten belüli folyamatokon kívül befolyásolhatják mechanikai, kémiai, és környezeti hatások. Kutatócsoportunk azt vizsgálja, hogy a különböző környezeti hatások, pufferek, tápoldatok, vagy a sejtfelszíni glikokálix meghatározott komponenseinek enzimatikus emésztése hogyan befolyásolja a sejtek tapadását, adhéziós folyamatait. Az alapkutatási relevanciákon túl, a sejtadhézió pontosabb megértése előre viheti új gyógyszerek és bioanyagok kifejlesztését, valamint a szövetmérnökséget.
Glikokálix és sejtadhézió
A sejtek felszínét egy szénhidrátokból és fehérjékből álló glikokálix réteg borítja. Ez nem csak védelemmel látja el a sejtet, hanem fontos, eddig még részleteiben feltáratlan szerepe van a sejtadhézióban. A szakirodalom nem egységes azzal kapcsolatban, hogy a poliszacharidok és egyéb sejtfelszíni molekulák milyen hatással vannak az adhézióra. Enzimatikus emésztésekkel eltávolíthatók vagy módosíthatók a különböző glikokálix komponensek, aminek hatására megváltozhat a sejtek viselkedése. Csoportunk bizonyos glikokálix komponensek célzott emésztésén keresztül szeretne pontosabb képet kapni az egyes glikokálix alkotórészek sejtadhézióban betöltött szerepéről[1].
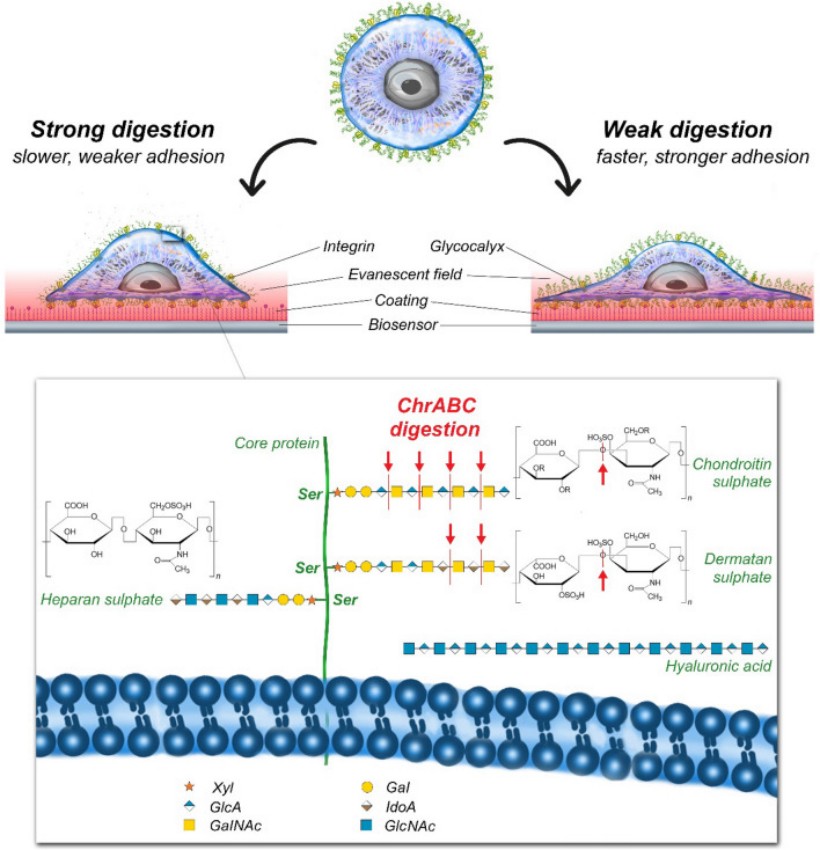
1. ábra: A glikokálix enzimatikus emésztése és a folyamat optikai bioszenzoros mérésének sematikus ábrája [1].
A glikokálix enzimatikus emésztése során megváltozik a sejtek felületi töltése, amit kutatócsoportunk zeta potenciál méréssel vizsgál. Korábbi kísérletek eredményei azt mutatták, hogy HeLa sejtek kis koncentrációjú ChrABC enzimes kezelése fokozta, míg a nagyobb koncentrációjú emésztés gyengítette az adhéziót. Ebből az következik, hogy az enzim koncentrációjától erősen függ, hogy a glikokálix réteg módosítása milyen hatással van az adhézióra [1].
Ez az effektus előreviheti a gyógyszerkutatást, a szövetmérnökséget, valamint lehetőséget nyit az adhézió újszerű, specifikus szabályozására is.
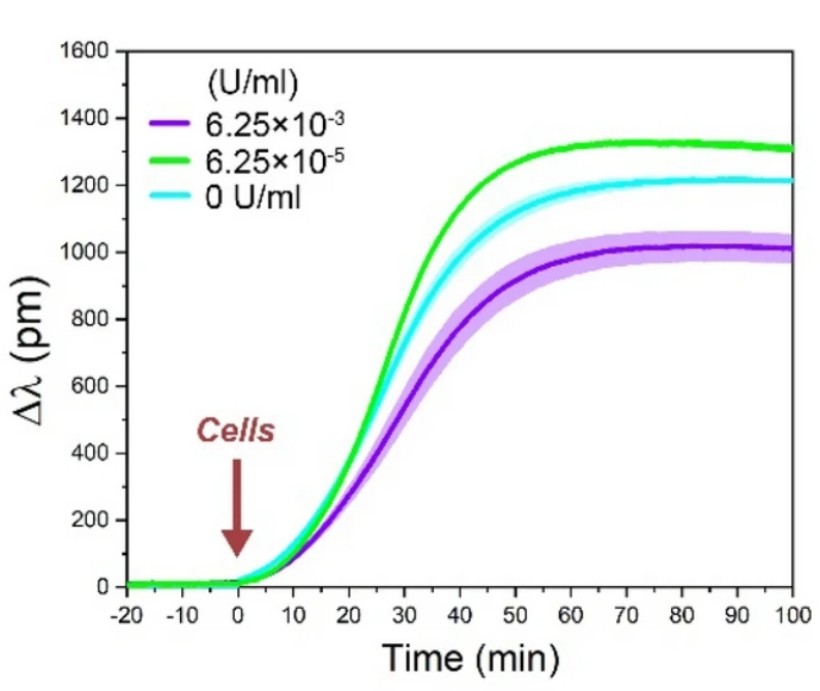
2. ábra: Reprezentatív sejtadhéziós kinetikai görbék 50% PP: PPR felületen. Az adhéziót egy szigmoid görbe írja le melynek a szaturációs értéke eltérő a különböző enzim koncnetrációk esetén: a 6.15 × 10-5 U/ml-es enzimatikus emésztés növelte, míg a 6.15 × 10-3 U/ml-es csökkentette a bioszenzor jelet a referencia 0 U/ml-hez képest. Az ábrán a görbék átlaga és szórása látható [1].
Sejtadhézió statikus és dinamikus környezetben
Statikus környezetben a sejtadhéziós folyamatokat elsősorban a sejtfelszíni receptorok, az extracelluláris mátrix fehérjék és a sejtmembrán szerkezetének változásai határozzák meg. Ilyen környezetben a sejtek fokozatosan stabilizálódnak a felszínen, és a kölcsönhatások viszonylag állandó erők hatására jönnek létre. A statikus környezet lehetővé teszi az adhéziós kapcsolatok hosszú távú kialakulását, így az ebből eredő morfológiai és funkcionális változások vizsgálata is lehetséges.
Ezzel szemben dinamikus környezetben, ahol a sejtek folyadékáramlásnak vannak kitéve, az adhézió jelentős kihívásokkal néz szembe. A nyíróerők befolyásolják a sejtfelszíni kapcsolatokat, ami az adhéziós fehérjék átrendeződéséhez és akár a sejtek leválásához is vezethet. Kísérleteinkben azt vizsgáljuk, hogy a dinamikus környezet, különböző áramlási sebességek alkalmazásával, hogyan befolyásolja a sejtek adhézióját [2].
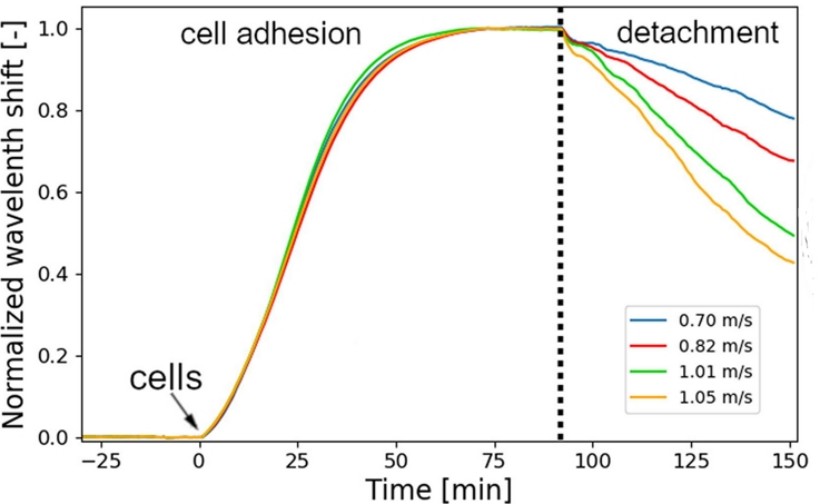
Figure 3: Reprezentatív sejtadhéziós görbék és a különböző áramlási sebességek által kiváltott sejtleválási karakterisztikák [2].
Alacsonyabb nyíróerők esetén a sejtek fokozatosan alkalmazkodnak, míg nagyobb nyíróerők esetén egyes sejtek leválnak.
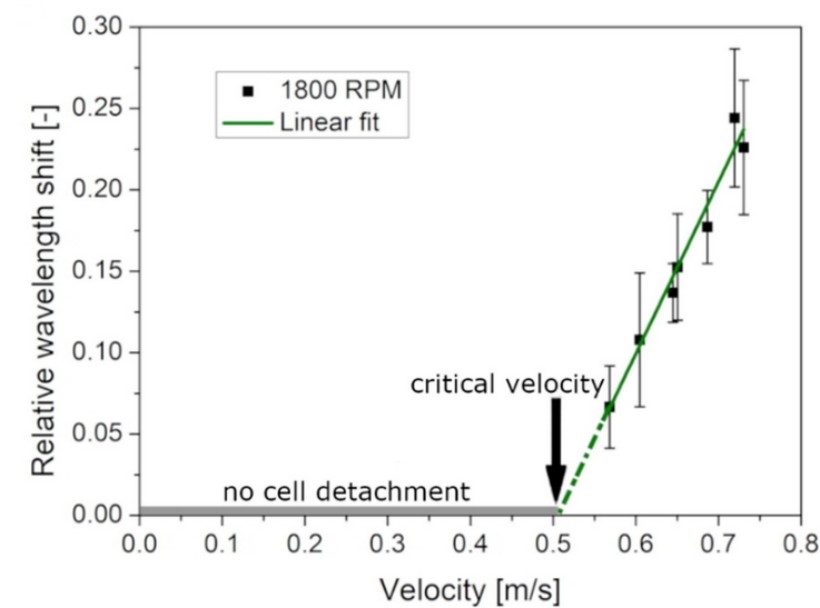
Figure 4: Sejtek leválási aránya az 1800 RPM-es forgatási sebességű mérésből a sebesség függvényében és az illesztett lineáris függvény [2].
Ezen jelenségek különösen fontosak az érrendszeri betegségek és a rákos sejtek áttétképződésének megértéséhez, mivel a mechanikai erők jelentős szerepet játszanak ezekben a folyamatokban.
Kutatócsoportunk egyik célja a sejtek adhéziós tulajdonságainak megértése különböző környezetekben, különös tekintettel a statikus és dinamikus körülményekre, valamint a glikokalix réteg enzimatikus módosításainak hatásaira. Az ilyen kutatások hozzájárulhatnak a sejtek mechanobiológiájának mélyebb megértéséhez és új terápiás stratégiák kifejlesztéséhez.
Sejtadhéziós mérésekhez használt különböző technikáink:
A. Optikai bioszenzoros mérések
Csoportunk a HUN-REN EK MFA Nanobioszenzorika Laboratóriummal (www.nanobiosensorics.com) kollaborációban, jelölésmentes optikai bioszenzorokkal vizsgálja a sejtadhéziót. Ezen műszerek jelölő molekulák nélküli nagy áteresztőképességű valós idejű méréseket tesznek lehetővé. A technika érzékeny a szenzorfelület feletti 200 nm-es rétegben bekövetkező törésmutatóváltozásra, és így lehetővé teszi az indirekt, valós idejű adhézió mérést. A technikával különböző biológiai folyamatok precíz időfelbontás mellett tanulmányozhatók és az adatokra kinetikai modellek illeszthetők [3]. Jelölésmentes optikai bioszenzorokat használva egyedi sejtek és endotél rétegek adhézióját vizsgáljuk. Emellett különböző molekulák adhézióra gyakorolt hatását is tanulmányozzuk.

5. ábra: Bioszenzor lemez [4].

6. ábra: Az optikai bioszenzorok működésének sematikus ábrája. A lézerfény egy optikai hullámvezető rétegben terjed és a szenzorfelület felett evaneszcens teret kelt, amin keresztül detektálni tudjuk a kitapadt sejtek adhéziós erősségét [5].
B. Fluidikai erőmikroszkópos mérések
Egyedi sejtek adhéziós erejét adott időpillanatban fluidikai erőmikroszkópot (FluidFM) használva a HUN-REN EK MFA Nanobioszenzorika Laboratóriumban (www.nanobiosensorics.com) direktben tudjuk mérni. A műszer konzoljának a belsejében egy mikrofluidikai csatorna található, mely egyik végével egy nyomáskontrollerhez kapcsolódik. Ha a csatornában negatív nyomást generálunk egy sejtet vagy mikrogyöngyöt hozzá tudunk rögzíteni a konzol végén található apertúrához, majd túlnyomással gyorsan el tudjuk távolítani [6].
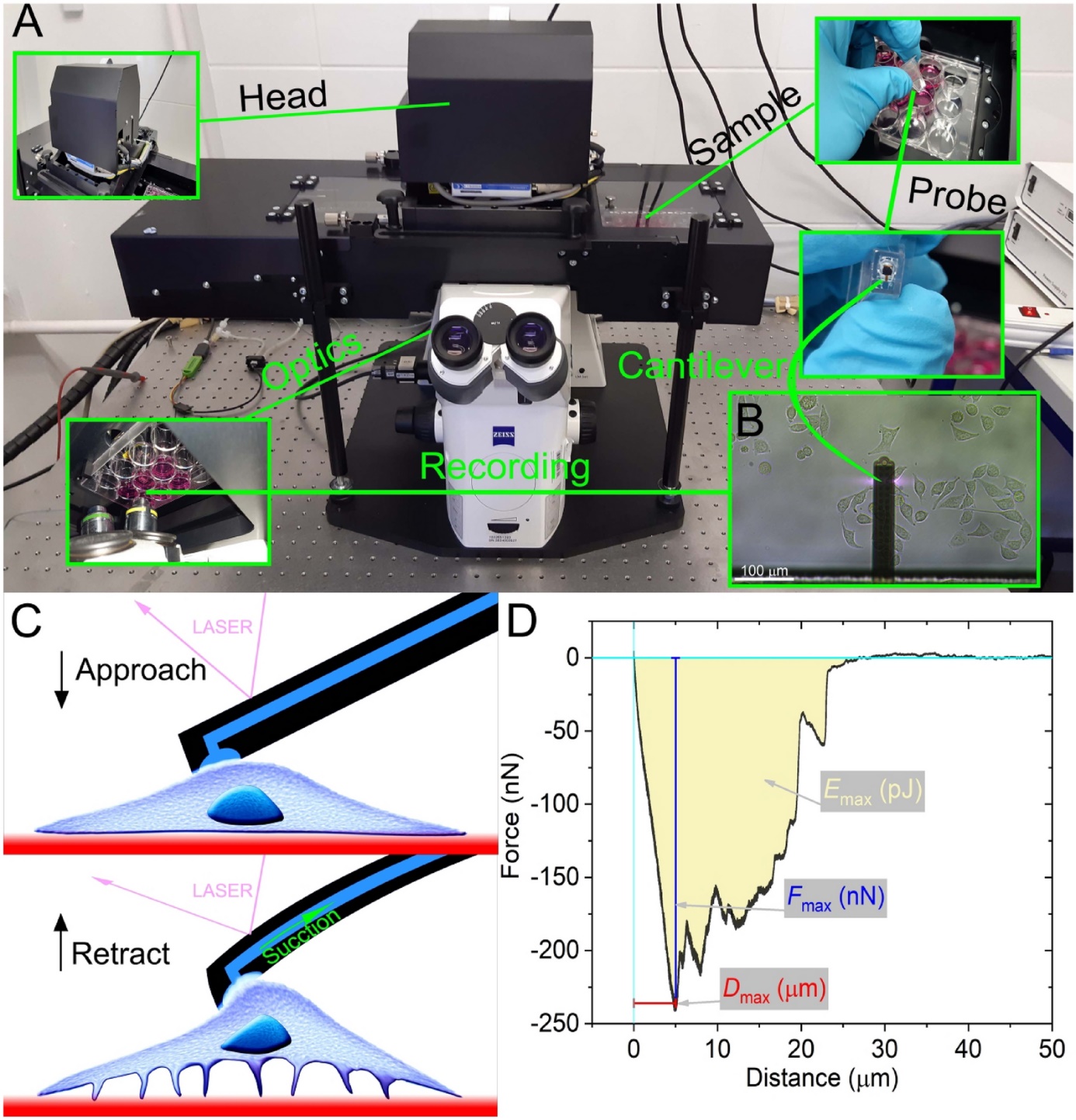
7. ábra: A FluidFM-es adhéziómérések menete [6].
Ugyanezen technikával sejt-sejt kölcsönhatások is tanulmányozhatók. Kutatócsoportunk Prof. Deli Mária Biológiai Barrierek Kutatócsoportjával kollaborációban endotélsejteket cARLA molekula koktéllal kezelt, így olyan vér-agy gát modelleket kidolgozva, amiken keresztül pontosabb képet kaphatunk az agyi érrendszeri megbetegedésekről, és megjósolható bizonyos gyógyszermolekulák bejutása az agyba [7].
Precíz nyomás és időkontrollt alkalmazva, a sejtmembrán átlyukasztását követően pico liter térfogat nagyságrendben anyagot tudunk injektálni egyedi sejtek citoplazmájába vagy sejtmagjába [8]. Ezen technikát felhasználva fluoreszcens festéket injektálunk egyszeres sejtréteget alkotó endotél sejtekbe, majd különböző időpillanatokban megvizsgáljuk, hogy az adott anyag a környező sejtekbe hogyan terjedt szét, valamint miként befolyásolta a sejtadhéziót. A kollaborációban végzett munkánk során endotélsejtekbe cARLA-t injektálunk. Korábbi diffúzión alapuló kísérletek azt mutatták cARLA hozzáadása után megerősödnek a sejt-sejt kapcsolatok. Fluoreszcens festék és cARLA egyidejű injektálását követően azt tanulmányozzuk, hogy a vér-agy gát érése hogyan változtatja meg a réskapcsolatokon keresztüli információ átadásátt a szomszédos sejtek között.
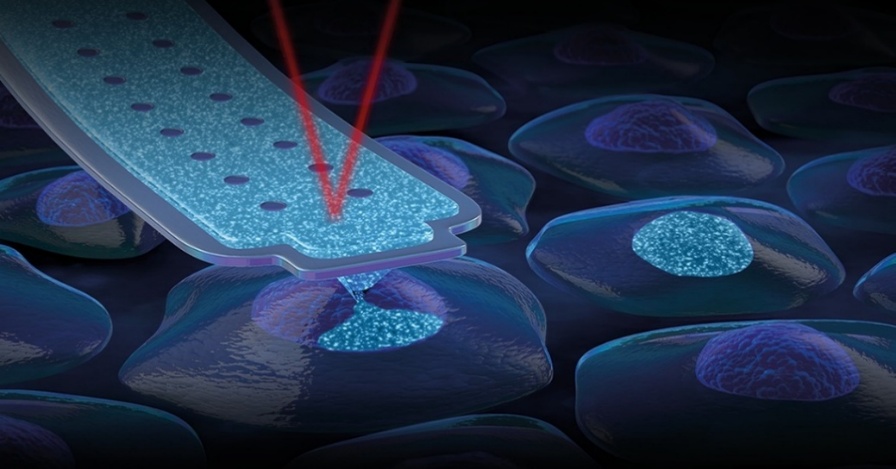
8. ábra: Injektálás egyedi sejtekbe FluidFM-mel (www.cytosurge.com.)
Források:
[1] Kanyo N, Kovacs KD, Saftics A, Szekacs I, Peter B, Santa-Maria AR, Walter FR, Dér A, Deli MA, Horvath R. Glycocalyx regulates the strength and kinetics of cancer cell adhesion revealed by biophysical models based on high resolution label-free optical data. Sci Rep. 2020 Dec 30;10(1):22422. doi: 10.1038/s41598-020-80033-6. PMID: 33380731; PMCID: PMC7773743.
[2] Kovács et al. Label-free tracking of whole-cell response on RGD functionalized surfaces to varied flow velocities generated by fluidic rotation, Journal of Colloid and Interface Science, Volume 599, 2021, Pages 620-630, ISSN 0021-9797, https://doi.org/10.1016/j.jcis.2021.04.091.
[3]Sztilkovics M, Gerecsei T, Peter B, Saftics A, Kurunczi S, Szekacs I, Szabo B, Horvath R. Single-cell adhesion force kinetics of cell populations from combined label-free optical biosensor and robotic fluidic force microscopy. Sci Rep. 2020 Jan 9;10(1):61. doi: 10.1038/s41598-019-56898-7. PMID: 31919421; PMCID: PMC6952389.
[4] https://nanobiosensorics.com
[5] Kanyo N, Kovács KD, Kovács SV, Béres B, Peter B, Székács I, Horvath R. Single-cell adhesivity distribution of glycocalyx digested cancer cells from high spatial resolution label-free biosensor measurements. Matrix Biol Plus. 2022 Feb 5;14:100103. doi: 10.1016/j.mbplus.2022.100103. PMID: 35243300; PMCID: PMC8857652.
[6] Ágoston G. Nagy, Nicolett Kanyó, Alexandra Vörös, Inna Székács, Attila Bonyár, Robert Horvath. Population distributions of single-cell adhesion parameters during the cell cycle from high-throughput robotic fluidic force microscopy. Sci Rep 12, 7747 (2022).
[7] G. Porkoláb, M. Mészáros, A. Szecskó, J.P. Vigh, F.R. Walter, R. Figueiredo, I. Kálomista, Z. Hoyk, G. Vizsnyiczai, I. Gróf, J. Jan, F. Gosselet, M.K. Pirity, M. Vastag, N. Hudson, M. Campbell, S. Veszelka, & M.A. Deli, Synergistic induction of blood–brain barrier properties, Proc. Natl. Acad. Sci. U.S.A. 121 (21) e2316006121, https://doi.org/10.1073/pnas.2316006121 (2024)
[8] Kovács, K. D., Visnovitz, T., Gerecsei, T., Peter, B., Kurunczi, S., Koncz, A., Németh, K., Lenzinger, D., Vukman, K. V., Balogh, A., Rajmon, I., Lőrincz, P., Székács, I., Buzás, E. I., & Horvath, R. (2023). Nanoinjection of extracellular vesicles to single live cells by robotic fluidic force microscopy. Journal of Extracellular Vesicles, 12, e12388. https://doi.org/10.1002/jev2.12388

tudományos főmunkatárs

tudományos főmunkatárs

PhD hallgató

PhD hallgató
 HORVÁTH Róbert
HORVÁTH Róbert
|
tudományos főmunkatárs | publikációk | CV |
 MARTINS Ana
MARTINS Ana
|
tudományos főmunkatárs | publikációk | CV |
 RAJMON Imola
RAJMON Imola
|
PhD hallgató | publikációk | CV |
 VARGA Sebestyén
VARGA Sebestyén
|
PhD hallgató | publikációk | CV |