Integrált Paramágneses Rezonancia és Optikai, Sok-Dimenziós Bio-Spektroszkópia Labor
iPRO-MD-BioSpec @ HUN-REN Szegedi Biológiai Kutatóközpont
Koordinátor: Páli Tibor, Molekuláris Biofizika Kutatócsoport, Biofizikai Intézet
Koncepció és jövőkép
A spektroszkópiai technikák kulcsfontosságúak a biofizikában, mivel egyedülálló információkat tudnak nyújtani a biológiai rendszerekről. A legmodernebb spektroszkópia példátlan térbeli (akár atomi) és időbeli (akár femtoszekundumos) részleteket ad még a natív biológiai mintákban is. Koncepciónk és jövőképünk a következőképpen fejlődött: (i) Egymást kiegészítő módszerek kombinációját régóta alkalmazzuk a biomolekuláris szerkezetről és dinamikáról szerzett információk megsokszorozására. A kísérleti adatokat következetesen értelmezzük részletes molekuláris és fizikai modellekben, és összekapcsoljuk a biológiai funkcióval. (ii) Amikor csak lehetséges, ugyanazt a mintát mérjük kiegészítő spektroszkópiai technikákkal, mert így az adatok minősége és konzisztenciája jelentősen megemelhető. Összekapcsolt spektroszkópiai infrastruktúránk magját az EPR és a fluoreszcencia alkotja. Hatékony integráció lehetséges optikai szálakkal és áramlási rendszerekkel (folyékony mintákhoz) – ezt már prototípusként teszteltük az EPR és a fluoreszcencia spektrométer (optikai szállal), valamint az EPR, egy spektrofotométer és egy törésmutató-mérő eszköz (átfolyó rendszerrel) között. (iii) A multimodális (paramágneses rezonancia és számos optikai) spektroszkópia integrálása után a spektrumok szisztematikusan rögzíthetők, és rengeteg adat nyerhető többdimenziós mátrix formájában. Ezen adatok magas információtartalma mesterséges intelligenciával (MI) elemezhető, hogy bármely biológiai rendszer bizonyos releváns fiziológiai állapotait ujjlenyomatként lehessen meghatározni. (iv) Emellett a paramágneses centrumok (spinjelölők, szabad gyökök, fémkomplexek) és fluoreszcens molekuláris csoportok (natív vagy festékek) közötti elektronátviteli kölcsönhatások detektálásán is dolgozunk EPR-fluoreszcencia beállításban, száloptikával összekapcsolva. Ez világszerte páratlan módon nemcsak egyidejű EPR és fluoreszcencia méréseket tesz lehetővé ugyanazon a mintán (az EPR rezonátorban), hanem a fluoreszcens molekuláris csoportok és a szabadgyökök, a spinjelölők és a paramágneses fémközpontok közötti kölcsönhatások közvetlen detektálását is, megnyitva egy teljesen kiaknázatlan területet, amely új lehetőségeket kínál a biológiai minták szerkezeti és dinamikus adatainak meghatározására.

Az iPRO-MD-BioSpec kutatási eszközei
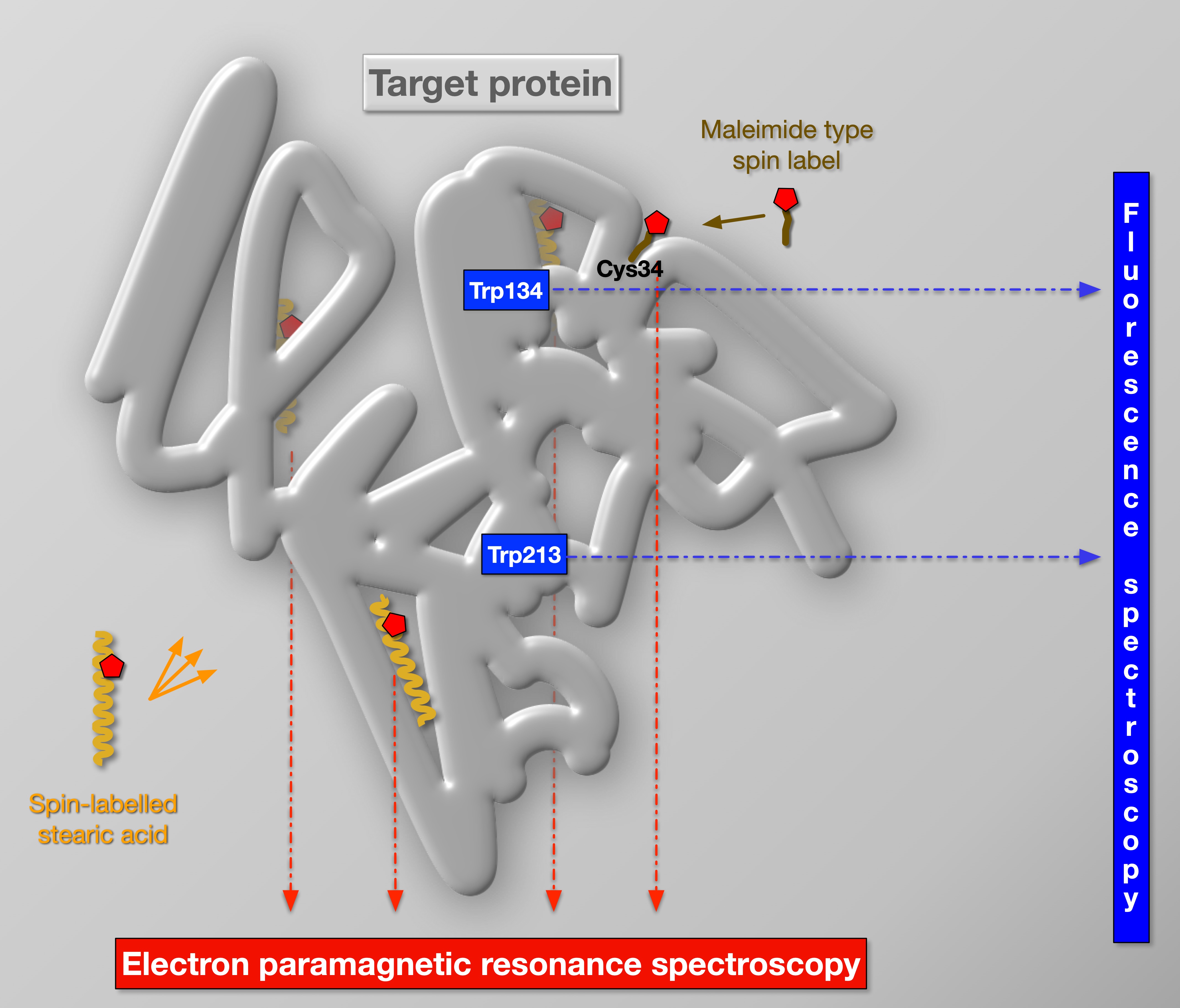
• Elsődleges és legnagyobb értékű (~1 millió EUR) műszerünk egy Bruker ELEXSYS E580 X-sávú folyamatos hullámú és impulzusos FT-elektron paramágneses rezonancia (EPR) spektrométer, amelyet 2018-ban helyeztünk üzembe. Az EPR a legközvetlenebb és leghatékonyabb módszer a paramágneses molekulák vizsgálatára. Drága és nehéz technika, de erős multi- és interdiszciplináris kutatásokban alkalmazható a fizika, a kémia, a biológia és az orvostudomány releváns problémáinak megoldásában, mivel a paramágneses molekulák különböző osztályai (fémkomplexek, szabad gyökök, spinjelölők) a legmodernebb alapkutatások célpontjai és tárgyai ezekben a tudományterületeken. Az EPR-t egyre inkább használjuk alkalmazott kutatásban is. Az EPR a 70-es évek óta a BRC egyik legproduktívabb spektroszkópiai módszere (több mint 70 kutatási cikkhez járult hozzá). Új E580 spektrométerünk Közép- és Kelet-Európa legmagasabb minőségű és legjobban felszerelt EPR spektrométere: négy különböző rezonátorral, tetszőleges hullámforma-generátorral, elektron-mag kettős rezonancia egységgel, valamint hélium és nitrogén hőmérséklet-szabályozókkal rendelkezik (5-500K lefedése). A műszer rendelkezik a legmodernebb folyamatos (CW) és impulzusos/FT mérési módokkal. Az E580-as műszerünket főként helyspecifikus spinjelölésre és spincsapdázásra (szabadgyökök kimutatására) használjuk, de EPR kísérleteket is végzünk fémkomplexeken és fémfehérjéken is.
• A Horiba (Jobin-Ivon) Fluorolog 3 (FL3-222) moduláris fluoreszcencia spektrométer időkorrelált egyfotonszámlálással (TCSPC), 96 lemezes leolvasóval, előlapi, ferde fluoreszcencia-detektálással (szilárd mintákhoz) és termosztáttal van felszerelve. A műszert a közelmúltban "T-karú" konfigurációra frissítettük, ami két emissziós egységet jelent, független monokromátorokkal, polarizátorokkal és detektorokkal. Az FL-322 fluoreszcencia spektrométerünk a BRC egyik leggyakrabban használt műszere rutinkísérletekhez, számos független projektet szolgált ki (és ~20 publikációt az elmúlt 5 évben).
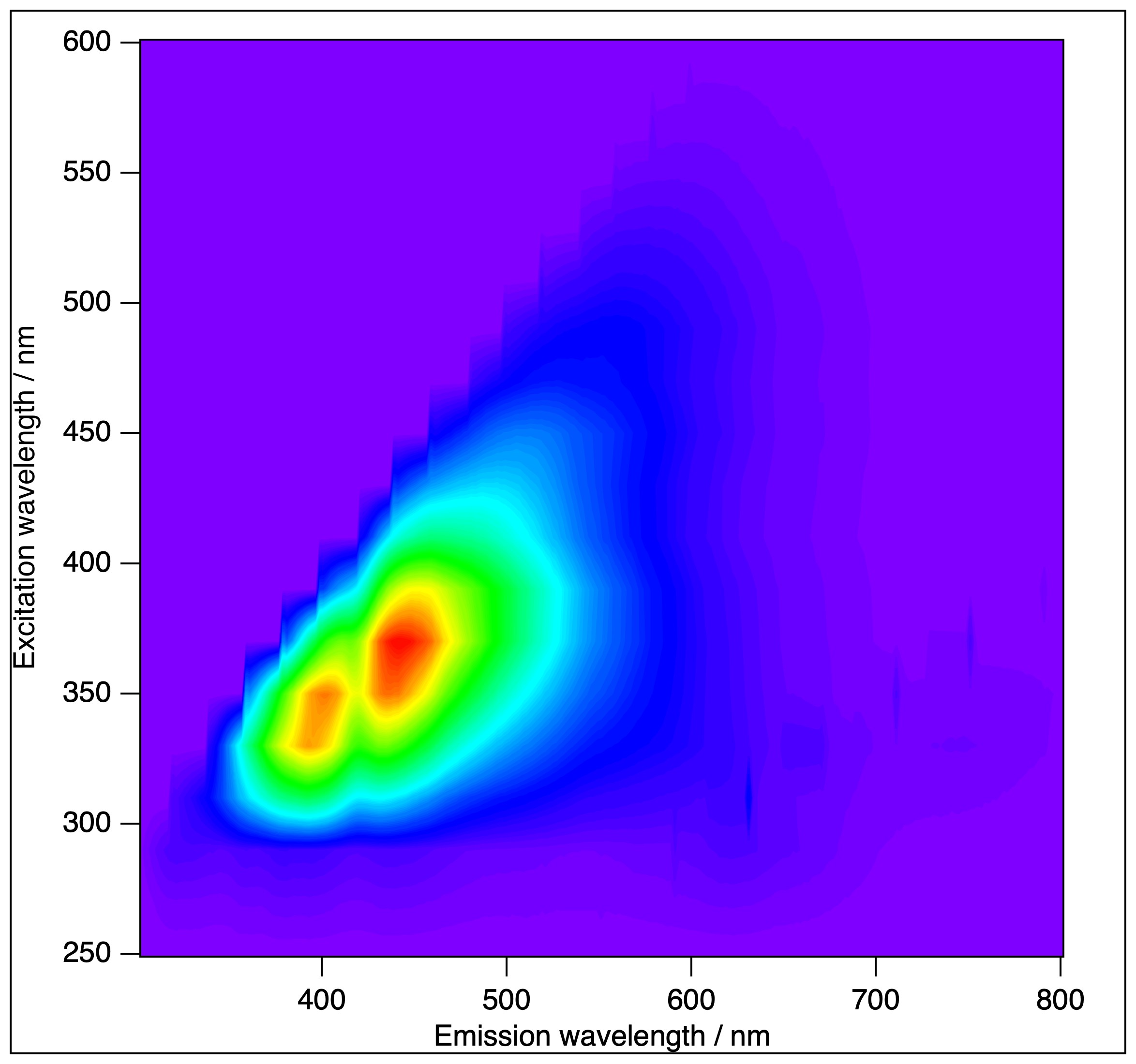
• A Femtobiológiai laboratórium egy lézervezérelt fluoreszcencia berendezés, amely képes a fluoreszcencia kinetikájának detektálására a 100 fs – 10 ns időablakban és a teljes látható spektrális tartományban, valamint kifinomult, egyedi szoftverekkel a fluoreszcencia kinetikai adatok elemzésére. Az időfelbontásos fluoreszcencia spektroszkópiai berendezés pumpálólézerének harmadik harmonikus generációja új molekulaosztályokat hozott potenciális kutatási célpontokká. Ez az egyetlen olyan berendezés Magyarországon, amely a fluoreszcencia felkonverzióját és az időkorrelált egyfoton-számlálást ötvözi, egyedi időfelbontást és mérési intervallumot biztosítva. Az ELI ALPS-ban (Szeged) egy állandó munkaállomást is működtetünk a fényenergiát felhasználó biológiai rendszereken lejátszódó ultragyors folyamatok tanulmányozására. Az alkalmazandó mérési technikák részben a femtoszekundumos többdimenziós elektronikus spektroszkópia legmodernebb technológiájának bővítésén, részben pedig az alacsony intenzitású fényindukált koherens THz-sugárzás detektálására kifejlesztett módszereink fejlesztésén alapulnak. A munkaállomás nyilvánosan elérhető a felhasználók számára.
• Kinetikus optikai spektroszkópiai laboratórium. Általános kemometriai módszereket fejlesztünk és alkalmazunk spektrális adatmátrixok elemzésére, a biológiai folyamatok és rendszerek mögöttes fizikai jelenségeinek meghatározása érdekében. Emellett a „színes” fehérjék biofotonikus és bioelektronikai alkalmazásokban való integrációjának lehetőségeit vizsgáljuk. Fő kísérleti berendezésünk egy hangolható Nd-Yag + OPO impulzuslézerből áll, amely < 10 ns aktinikus impulzusokat biztosít, és egy folyamatos fehér mérőfényforrásból a teljes látható tartományban. A gerjesztett minta időben felbontott spektrumai <100 ns-tól felfelé mérhetők. Ugyanebben a kísérleti elrendezésben nagy időfelbontású, egyhullámhosszú kinetika is mérhető.
• Rendelkezésre áll továbbá: Microcal VP-DSC nagyérzékenységű differenciális pásztázó kaloriméter és Bruker Vertex 70 Fourier-transzformációs infravörös spektrométer polarizált csillapított teljes belső visszaverődés (PATIR) opcióval és termosztáttal.
iPRO-MD-BioSpec alapkutatásban
Elsősorban a biomembránokra és fehérjékre összpontosítunk, a konkrét kutatási területek pedig a következők: (i) Kiválasztott ionszállító membránfehérjék szerkezet-funkció kapcsolatának és működési mechanizmusának molekuláris biofizikája. (ii) Spektroszkópiai adatok bioinformatikával, mesterséges intelligenciával (MI) és molekuláris mechanikával (MM) és -dinamikával (MD) való kombinálása a membránok és fehérjék atomisztikus és fizikai modelljeinek felépítése és hatásmechanizmusuk megértése érdekében. (iii) Fehérje-lipid kölcsönhatások és membránátrendeződések fotoszintézisben, membránfúzióban és lipid alapú gyógyszerbeviteli folyamatokban. (iv) Kromofor prosztetikus csoportokkal rendelkező fehérjék esetében a látható és UV-tartományban végzett spektroszkópiai és kinetikus spektroszkópiai vizsgálatok alapvető információkat nyújtanak a fehérje funkciójáról. (v) Ezenkívül erre az egyedülálló molekuláris biofizikai módszertanra támaszkodva számos, a fotoszintézissel, a mezőgazdasággal és a környezetvédelemmel kapcsolatos együttműködési projektben is részt veszünk, például a szabad gyökök, a natív biomembránok, a membránhoz kapcsolódó fehérjék és a gyógyszerbeviteli folyamatok vizsgálatában.
iPRO-MD-BioSpec alkalmazott kutatásban
Egyedülálló kutatási infrastruktúránknak köszönhetően számos hazai és nemzetközi K+F projektben veszünk részt, amelyek célja a környezet védelme és az életminőség javítása. Például rutinszerűen használjuk az EPR-t élelmiszer köztes és végtermékek szabadgyök-tartalmának jellemzésére. Magyar-egyiptomi és BRC-Szegedi Tudományegyetem együttműködésekben segítjük a szennyvíztisztítási technológia fejlesztését a szerves szennyeződésektől megtisztított szelektív membránszűrők spektroszkópiai jellemzésével. Egy új, orvosi irányultságú közös projektben a Pécsi Tudományegyetem Biofizikai Intézetével (Magyarország) a cukorbetegek eritrocitáinak plazmamembránjában található spektroszkópiai ujjlenyomatokat keressük.
Fontosnak tartjuk a kutatási együttműködések szinergikus hatásait és annak kölcsönös előnyeit. Műszereink számos projektet szolgálnak ki a BRC-n belül és kívül (beleértve a nemzetközi együttműködéseket is). Kérjük, vegye fel velünk a kapcsolatot, hogy megbeszélhessük, mit hozhat az iPRO-MD-BioSpec az Ön projektjéhez (legyen szó alap- vagy alkalmazott kutatásról a biológia, az orvostudomány, a kémia, a fizika és az anyagtudományok bármely területén). Független hozzáférés rutin fluoreszcencia és optikai abszorpciós kísérletekhez is lehetséges, aláírt megállapodás és bizonyos alapvető feltételek teljesülése esetén (részletekért vegye fel velünk a kapcsolatot).
Válogatott friss publikációk
*Páli, T., and Kóta, Z. (2019). Studying Lipid-Protein Interactions with Electron Paramagnetic Resonance Spectroscopy of Spin-Labeled Lipids. Methods Molecular Biololgy 2019, 2013, 529-561.
Krekic, S., Zakar, T., Gombos, Z., Valkai, S., Mero, M., Zimányi, L., *Heiner, Z. and *Dér, A. (2020). Non-linear optical investigation of microbial chromoproteins. Frontiers in Plant Science 11:547818. DOI
Lingvay, M., Akhtar, P., Sebők-Nagy, K., Páli, T., and *Lambrev, P. H. (2020). Photobleaching of Chlorophyll in Light-Harvesting Complex II Increases in Lipid Environment. Frontiers in Plant Science 11, 849. DOI
*Zimányi, L., Thekkan, S., Eckert, B., Condren, A.R., Dmitrenko,O., Kuhn, L.R., Alabugin, I.V. and *Saltiel, J. (2020). Determination of the pKa values of trans-Resveratrol, a Triphenolic Stilbene, by Singular Value Decomposition. Comparison with Theory. J. Phys. Chem. A 124(31):6294-6302. DOI
Khoroshyy, P., Tenger, K., Chertkova, R.V., Bocharova, O.V., Kirpichnikov, M.P., Borovok, N., Groma, G.I., Dolgikh, D.A., Kotlyar, A.B. and *Zimányi, L. (2021) Kinetics and energetics of intramolecular electron transfer in single-point labeled TUPS-cytochrome c derivatives. Molecules 26(22):6976. DOI
Rehman, A. U., Bashir, F., Ayaydin, F., Kóta, Z., Páli, T., and *Vass, I. (2021). Proline is a quencher of singlet oxygen and superoxide both in in vitro systems and isolated thylakoids. Physiologia Plantarum 172, 7-18. DOI
Zimányi, L., Sipos, Á., Sarlós, F., Nagypál, R. and *Groma, G. (2021) Machine learning-based model selection and parameter estimation from kinetic data of complex first-order reaction systems. PLOS One 16(8): e0255675. DOI
Bérczi, A., Márton, Z., Laskay, K., Tóth, A., Rákhely, G., Duzs, Á., Sebők-Nagy, K., Páli, T., and *Zimányi, L. (2023). Spectral and Redox Properties of a Recombinant Mouse Cytochrome b561 Protein Suggest Transmembrane Electron Transfer Function. Molecules 28(5), 2261. DOI
Misra, R., Das, I., Dér, A., Steinbach, G., Shim, J-G., Busse, W., Jung, K-H., *Zimányi, L. and *Sheves, M. (2023) Impact of protein-chromophore interaction on the retinal excited state and photocycle of Gloeobacter rhodopsin: role of conserved tryptophan residues. Chemical Science 14:9951. DOI
Sebők-Nagy, K., Blastyák, A., Juhász, G., and *Páli, T. (2023). Reversible binding of divalent cations to Ductin protein assemblies-A putative new regulatory mechanism of membrane traffic processes. Frontiers in Molecular Biosciences 10, 1195010. DOI
Sebők-Nagy, K., Kóta, Z., Kincses, A., Fazekas, Á. F., Dér, A., László, Z., and *Páli, T. (2023). Spin-Label Electron Paramagnetic Resonance Spectroscopy Reveals Effects of Wastewater Filter Membrane Coated with Titanium Dioxide Nanoparticles on Bovine Serum Albumin. Molecules 28, 6750. DOI
Laczkó-Dobos, H., Bhattacharjee, A., Maddali, A.K., Kincses, A., Abuammar, H., Sebők-Nagy, K., Páli, T., Dér, A., Hegedűs, T., Csordás, G. and *Juhász, G. (2024). PI(4)P promotes Syntaxin 17 recruitment to autophagosomes for lysosomal fusion. Autophagy. DOI.
*Páli, T., Feniouk, B. and Wilkens, S. (2024). Editorial: Functions, Working Mechanisms, and Regulation of Rotary ATPases and Ductin Proteins. Frontiers in Molecular Biosciences 11, 1399421. DOI
*Emam, H. E., Koto , T., Sebők-Nagy, K., El-Shahat, M., Abdel-Gawad, H., *Páli, T. and *Abdelhameed, R. (2024) Synthesis, Spectroscopic Study and Carbofuran Adsorption of Mixed Metal (Co, Cu)@Ca-BTC Frameworks aimed at Wastewater Cleaning. Separation and Purification Technology DOI.