
Kutatás
1) Biológiai gátrendszerek modellezése chip-eszközökkel
Laborunk kutatásainak középpontjában a biológiai gátrendszerek - mint a bélhám, a légúti hám, szaruhártya és a vér-agy gát - vizsgálata áll. Kísérleteink során a barrierek minél élethűbb modellezésére több sejttípus együttes tenyésztésével létrehozott rendszereket (Veszelka és mtsai, 2018) alkalmazunk (1. ábra). Célunk a sejttenyészetes modellek új generációjának létrehozása humán sejtek valamint mikroelektronikai és mikrofluidikai chip-eszközök felhasználásával a biológiai gátakon keresztüli gyógyszerhatóanyag-átjutás és a gátrendszereket érintő betegségek vizsgálatára.
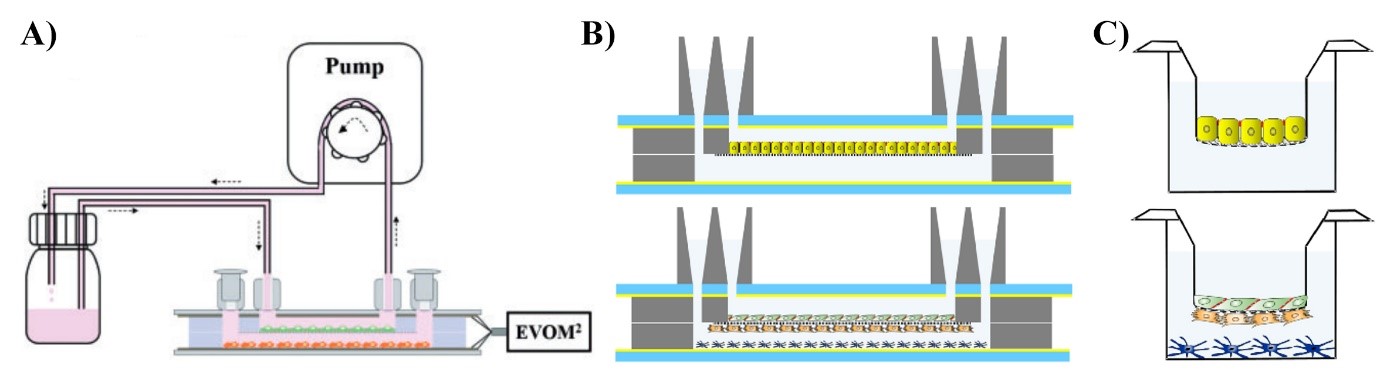
1. ábra. Dinamikus (A, B) és statikus (C) körülményeket létrehozó eszközök biológiai barrierek modellezésére. A chip-eszközök (B) és a tenyésztő betétek (C) membránján növesztett sejtrétegek két folyadékteret választanak el. A chip-eszközzel létrehozható a véráramlást utánzó folyadékáramlás (A), amellyel még élethűbbé tehető a vizsgált rendszer.
Kutatásainkhoz sejttenyésztő betéteken létrehozott statikus, valamint saját fejlesztésű mikroelektronikai biochipek felhasználásával létrehozott dinamikus modelleket használunk (Walter és mtsai, 2016; Kincses és mtsai, 2020; Santa-Maria és mtsai, 2021; 1. ábra). Ezek a modellek a modern biológiai barrier kutatás ma elérhető legfejlettebb eszközei, amelyek elősegítik, hogy kutatásaink nemzetközi szinten versenyképesek legyenek.
2) Hatóanyagok jobb átjuttatása biológiai gátrendszereken
Szervezetünk biológiai gátrendszerei, mint a bél- és légzőrendszer hámja, vagy az erek belső falát borító belhámsejtek rétege, védik testünket a különböző káros anyagoktól és teremtenek szabályozott körülményeket az élettani működésekhez. Ugyanakkor ezek a barrierek gyógyszerek bejutását is nehezítik, akadályozva ezzel számos betegség hatékony gyógyítását. A kutatócsoportunk a gyógyszerhatóanyagok biológiai barriereken való hatékonyabb átjuttatására a vér-agy gát szállítófehérjéit célzó nanorészecskéket hozott létre. A célzott nanorészecskék nem csak az agyi endotélsejtek rétegén való anyagátjutást, hanem azt követően más agyi sejttípusokba (Porkoláb és mtsai, 2020; 2. ábra) sőt őssejtből létrehozott mini-agyakba való bejutást is fokozzák (Mészáros és mtsai, 2023).
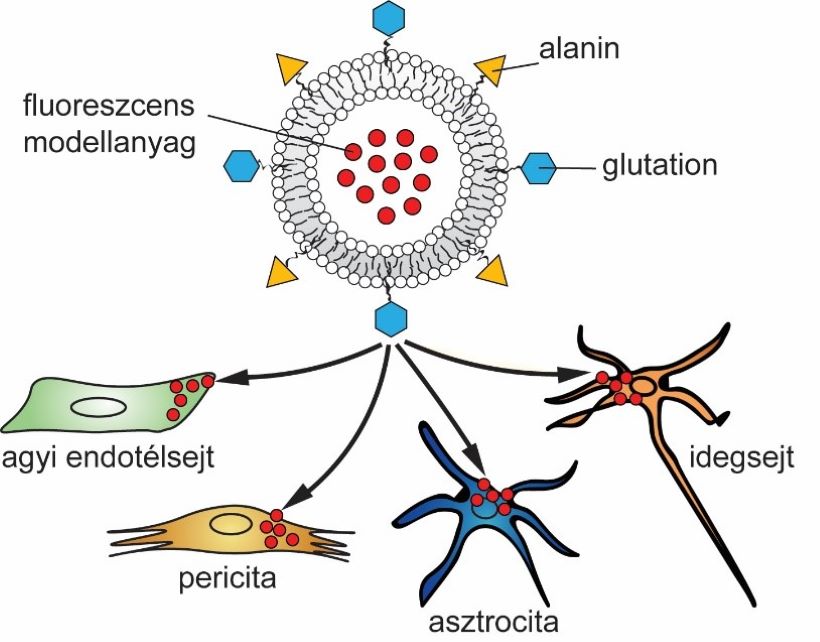
2. ábra. Az agyi endotélsejtek tápanyagszállító fehérjéit célzó nanorészecskék fokozzák a fluoreszcens modellanyag vér-agy gáton való átjutását és agyi pericitákba, asztrocitákba és idegsejtekbe történő bejutását.
3) Biológiai gátrendszerek károsodása kórállapotokban, és azok védelme
Mivel a biológiai gátrendszerek alapvető funkciója a szervezet és egyes szervek védelme, ezért sérülésük betegségekben súlyos következményekhez vezethet. A központi idegrendszert érintő különböző kórállapotok kialakulásában közvetlenül vagy közvetetten szerepet játszik a vér-agy gát sérülése, ami kiváltó okként vagy a kórfolyamat eredményeként hozzájárul az idegsejtek károsodásának súlyosbodásához. Célunk, hogy feltárjuk a betegségek létrejöttében kulcsfontosságú tényezők hatását a vér-agy gát működésére, és védőanyagokat azonosítsunk az agyi endotélsejtek védelmére és a károsító hatások kivédésére. Az általunk tanulmányozott kórfolyamatok közé tartozik többek között a kainsavval (Barna és mtsai, 2020) és citokinekkel kiváltott neuroinflammáció (Barabási 2023), illetve az akut hasnyálmirigy-gyulladás által kiváltott vér-agy gát károsodás (Walter és mtsai, 2023).
Válogatott közlemények
Selected publications
Barabási B, Barna L, Santa-Maria AR, Harazin A, Molnár R, Kincses A, Vigh JP, Dukay B, Sántha M, Tóth ME, Walter FR, Deli MA, Hoyk Z. Role of interleukin-6 and interleukin-10 in morphological and functional changes of the blood-brain barrier in hypertriglyceridemia. Fluids Barriers CNS. 2023, 20:15.
Barna L, Walter FR, Harazin A, et al. Simvastatin, edaravone and dexamethasone protect against kainate-induced brain endothelial cell damage. Fluids Barriers CNS. 2020;17:5.
Kincses A, Santa-Maria AR, Walter FR, Dér L, Horányi N, Lipka DV, Valkai S, Deli MA, Dér A. A chip device to determine surface charge properties of confluent cell monolayers by measuring streaming potential. Lab Chip. 2020;20:3792-3805.
Mészáros M, Phan THM, Vigh JP, Porkoláb G, Kocsis A, Páli EK, Polgár TF, Walter FR, Bolognin S, Schwamborn JC, Jan JS, Deli MA, Veszelka S. Targeting Human Endothelial Cells with Glutathione and Alanine Increases the Crossing of a Polypeptide Nanocarrier through a Blood-Brain Barrier Model and Entry to Human Brain Organoids. Cells. 2023,12:503.
Porkoláb G, Mészáros M, Tóth A, Szecskó A, Harazin A, Szegletes Z, Ferenc G, Blastyák A, Mátés L, Rákhely G, Deli MA, Veszelka S. Combination of alanine and glutathione as targeting ligands of nanoparticles enhances cargo delivery into the cells of the neurovascular unit. Pharmaceutics. 2020;12:635.
Santa-Maria AR, Walter FR, Figueiredo R, Kincses A, Vigh JP, Heymans M, Culot M, Winter P, Gosselet F, Dér A, Deli MA. Flow induces barrier and glycocalyx-related genes and negative surface charge in a lab-on-a-chip human blood-brain barrier model. J Cereb Blood Flow Metab. 2021, 41:2201-2215.
Veszelka S, Tóth A, Walter FR,Tóth AE, Gróf I, Mészáros M, Bocsik A, Hellinger É, Vastag M, Rákhely G, Deli MA. Comparison of a Rat Primary Cell-Based Blood-Brain Barrier Model With Epithelial and Brain Endothelial Cell Lines: Gene Expression and Drug Transport. Front Mol Neurosci. 2018,11:166.
Walter FR, Harazin A, Tóth AE, Veszelka S, Santa-Maria AR, Barna L, Kincses A, Biczó G, Balla Z, Kui B, Maléth J, Cervenak L, Tubak V, Kittel Á, Rakonczay Z Jr, Deli MA. Blood-brain barrier dysfunction in L-ornithine induced acute pancreatitis in rats and the direct effect of L-ornithine on cultured brain endothelial cells. Fluids Barriers CNS. 2022, 19:16.

kutatóprofesszor

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

PhD hallgató

PhD hallgató

PhD hallgató

Szent-Györgyi diák
 DELI Mária
DELI Mária
|
kutatóprofesszor | publikációk | CV |
 VESZELKA Szilvia
VESZELKA Szilvia
|
tudományos főmunkatárs | publikációk | CV |
 HOYK Zsófia
HOYK Zsófia
|
tudományos munkatárs | publikációk | CV |
 WALTER Fruzsina
WALTER Fruzsina
|
tudományos munkatárs | publikációk | CV |
 BOCSIK Alexandra
BOCSIK Alexandra
|
tudományos munkatárs | publikációk | CV |
 HARAZIN András
HARAZIN András
|
tudományos munkatárs | publikációk | CV |
 MÉSZÁROS Mária
MÉSZÁROS Mária
|
tudományos munkatárs | publikációk | CV |
 GRÓF Ilona
GRÓF Ilona
|
tudományos munkatárs | publikációk | CV |
 VIGH Judit
VIGH Judit
|
PhD hallgató | publikációk | CV |
 PORKOLÁB Gergő
PORKOLÁB Gergő
|
PhD hallgató | publikációk | CV |
 SZECSKÓ Anikó
SZECSKÓ Anikó
|
PhD hallgató | publikációk | CV |
 LEMAITRE Lucien
LEMAITRE Lucien
|
Szent-Györgyi diák | publikációk | CV |