

A sejtek az élet alapvető építőelemei. Kutatócsoportunk interdiszciplináris megközelítést alkalmazva tanulmányozza különböző típusú sejtek jellemzőit és működését, valamint környezetükkel és más sejtekkel való kölcsönhatását. Erre alapozva a sejtek egyedi működésén túl célunk felderíteni a sejtpopulációk együttes viselkedését, illetve az összetett sejtközösségek működését.
Élvonalbeli mikrofabrikációs, optikai mikromanipulációs és mikroszkópiás technikákat alkalmazunk sejtek csapdázására, hosszútávú megfigyelésére és meghatározott mikrokörnyezet precíz előállítására. Lézeres direktíráson alapuló fotolitográfiás, illetve szoft-litográfiás módszerekkel, illetve kétfotonos fotopolimerizációs eljárással pontosan megtervezett struktúrákat tudunk elkészíteni a szubcelluláris méretektől (250 nm) a centiméterig terjedő skálán [1].

Mikrofabrikációs labor.
Olyan mikrofluidikai csipeket készítünk, melyekkel egyes baktérium sejteket és algákat csapdázunk, azok különböző jellemzőit és osztódását megfigyeljük, illetve a környezet hatását vizsgáljuk. Eszközünkkel tanulmányozzuk, hogyan alakul ki genetikailag azonos sejtek esetén a a fenotípus heterogenitása, vagyis megfigyelhető tulajdonságok sejtről sejtre való változatossága. Az általunk kidolgozott mikrostruktúrák lehetővé teszik osztódó baktériumsejtek esetén az utódok csapdázását és megfigyelését is. Így tanulmányozhatjuk a leszármazási viszonyok és a megfigyelhető tulajdonságok (fenotípus) közötti összefüggéseket, illetve a sejtek sok-sok generáción át történő öregedését.

Mikrofluidikai csip.
Intenzíven kutatjuk a holografikus optikai csipesz alkalmazási lehetőségeit. Dinamikus hologramok alkalmazásával infravörös lézernyalábból olyan optikai csapdarendszert állítunk elő, mely alkalmas számos sejt, vagy más mikroszkopikus részecske rögzítésére, és precíz térbeli mozgatására [2].
Egyes sejtek mérettartományában olyan holográfiás lézercsipesszel mozgatható mikroszerkezeteket készítünk, melyek jelentősen szélesítik a sejtmanipulációs lehetőségeket. Az eszökök alapvetően két részből állnak: az egyik a csapdázó fénnyel hat kölcsön („fogantyú”), a másik pedig a vizsgálni kívánt objektummal („próba”). Például egy mobil mikro-fényvezető [3] egyik végébe fluoreszcens gerjesztő fényt csatolva és a másik végét tetszőleges helyre, például sejtre irányítva a kilépő fénnyel lokálisan, célzottan gerjesztetünk fluoreszcenciát. Az eszközt az optikai csipesz segítségével három dimenzióban pontosan mozgathatjuk, akár egy sejt felszínének letapogatásához. A lokális gerjesztés hatékonyságát tűszerű próba fém nanorészecskékkel való bevonásával nagymértékben növelhetjük, illetve ez az eszköz fém-erősített Raman fluoreszcencia spektroszkópia elvégzését is lehetővé teszi [4]. Hasonló tűszerű próba ezenkívül egyedi sejtek felületének mechanikai feltérképezésére is alkalmas.
Csoportunk kifejlesztett egy precíz módszert, mellyel egyedi sejtek megfoghatók, forgathatók, több oldalról mikroszkóppal vizsgálhatók. A tomográfiás módszerekhez hasonló eljárással a sejtekről nagy felbontású háromdimenziós felvételek készíthetők, más módszerekhez (pl. konfokális mikroszkópia) képest jelentősen jobb minőségben.
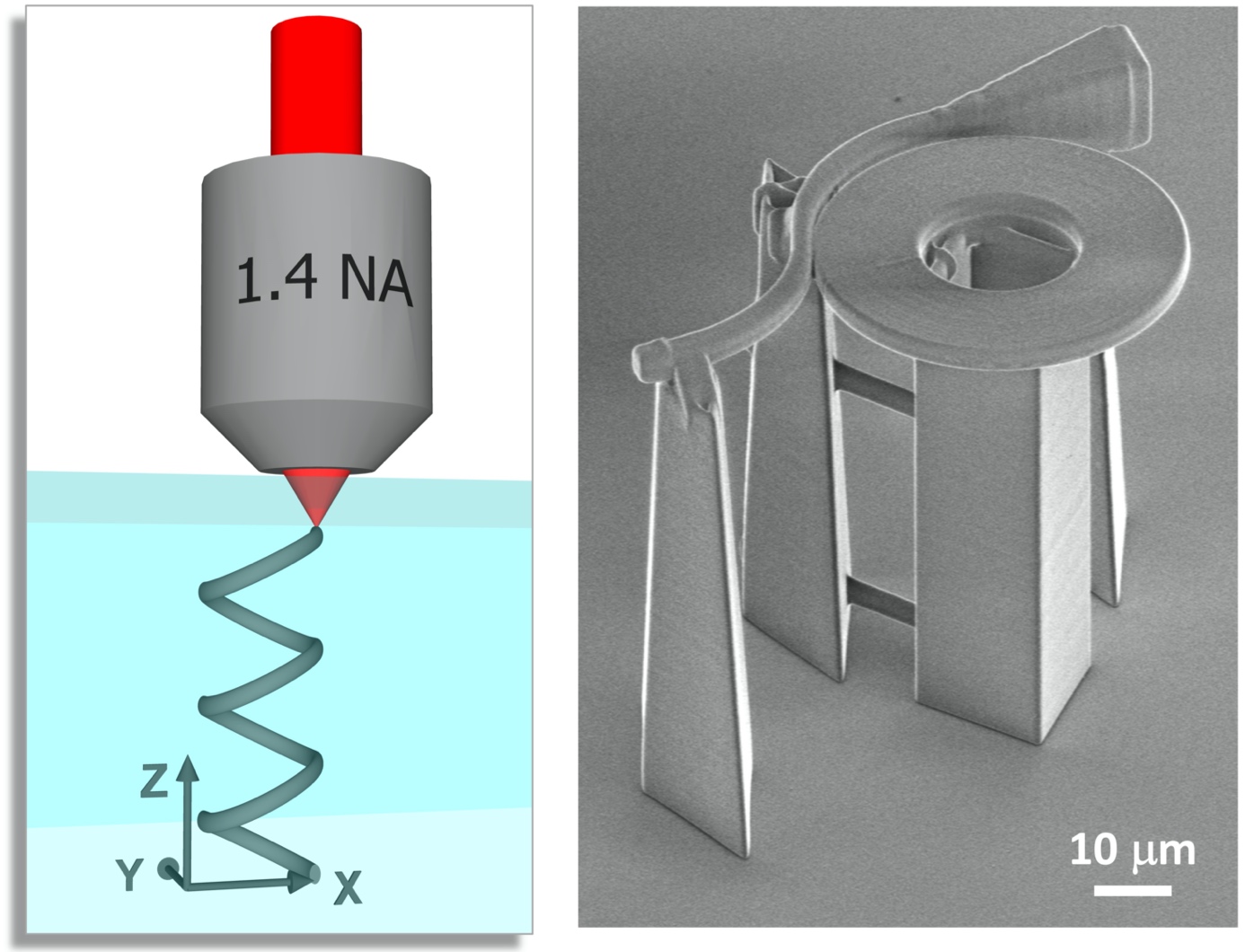
A fotopolimerizáció sematikus ábrázolása és egy fehérjedetektor elektronmikroszkópos képe.
Mikrofabrikációs eszközök segítségével tudjuk vizsgálni az úszó baktériumok fizikai (hidrodinamikai) sejt-sejt és sejt-felszín közötti kölcsönhatásait. Így mutattuk be például konvex felület mellett úszó baktériumok hidrodinamikai csapdázását, amely elősegíti a sejtadhéziót és a biofilm képződést. Mesterséges mikroszkopikus propellerekkel és holografikus optikai csipesszel kimutattuk a hidrodinamikai szinkronizáció jelenségét is, amely például flagellák és csillók együttes mozgása során lehet alapvető fontosságú.
Mikrofluidikai eszközökkel azt is tanulmányozzuk, hogy a sejtek egyedi tulajdonságai és viselkedése, valamint egymással és a környezettel való kölcsönhatásuk milyen populációszintű jelenségekhez vezet. Egy általunk kifejlesztett platform alkalmas kémiai gradiensek folyadékáramlás nélküli előállítására. Ilyen heterogén környezetben tanulmányozzuk baktériumok kemotaxisát, kommunikációját (quorum érzékelés), illetve evolúcióját. Hasonló eszközt alkalmazunk a fizikailag elválasztott, de kémiailag csatolt baktériumpopulációk egymásra gyakorolt hatásának kimutatására. Eredményeink hozzájárulnak a több fajból álló mikrobiális közösségek felépítésének és működésének megértéséhez.
[1] Sima, F. et al. ACS Applied Bio Materials 1:1667-1676 (2018), DOI: 10.1021/acsabm.8b00487
[2] Vizsnyiczai, G. et al. SPIE PROC 9922:992216 (2016), DOI: 10.1117/12.2237601
[3] Palima, D. et al. Opt. Expr., 20: 2004-2014 (2012), DOI: 10.1364/OE.20.002004
[4] Vizsnyiczai, G. et al. Langmuir, 31:10087–10093 (2015), DOI: 10.1021/acs.langmuir.5b01210
[5] Nagy, K. et al. Front Microbiol 13 Paper: 820738, 12 p. (2022), https://doi.org/10.3389/fmicb.2022.820738
[6] Wetherington, M. ET al. BMC Biology 20:1 Paper: 262 (2022) https://doi.org/10.1186/s12915-022-01462-5
[7] Nagy, K. et al. Front Microbiol 9 p. 496 (2018) https://doi.org/10.3389/fmicb.2018.00496
[8] Nagy, K. Biomicrofluidics 9:4 Paper: 044105 (2015) https://doi.org/10.1063/1.4926981
[9] Fekete, T. et al. ACS Appl Mater Inter 13:33 p39018 (2021) https://doi.org/10.1021/acsami.1c08454
[10] Grexa, I. et al. Micromachines 11:9 Paper: 882 (2020) https://doi.org/10.3390/mi11090882
[11] Vizsnyiczai et al. Biomed Opt Express 11:2 p945 (2020) https://doi.org/10.1364/BOE.379233
[12] Kelemen, L. et al. LAB ON A CHIP 19:11 p1985 (2019) https://doi.org/10.1039/c9lc00174c
[13] Vizsnyiczai, G. Nat Commun 11:1 Paper: 2340 (2020) https://doi.org/10.1038/s41467-020-15711-0

tudományos főmunkatárs, csoportvezető

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

ügyvivő-szakértő

ügyvivő-szakértő

PhD hallgató

emeritus kutatóprofesszor
 GALAJDA Péter
GALAJDA Péter
|
tudományos főmunkatárs, csoportvezető | publikációk | CV |
 KELEMEN Lóránd
KELEMEN Lóránd
|
tudományos főmunkatárs | publikációk | CV |
 VIZSNYICZAI Gaszton
VIZSNYICZAI Gaszton
|
tudományos munkatárs | publikációk | CV |
 NAGY Krisztina
NAGY Krisztina
|
tudományos munkatárs | publikációk | CV |
 BUZÁS András
BUZÁS András
|
tudományos munkatárs | publikációk | CV |
 FEKETE Tamás
FEKETE Tamás
|
tudományos munkatárs | publikációk | CV |
 ÁBRAHÁM Ágnes
ÁBRAHÁM Ágnes
|
ügyvivő-szakértő | publikációk | CV |
 DÉR László
DÉR László
|
ügyvivő-szakértő | publikációk | CV |
 IVÁNYI T. Gergely
IVÁNYI T. Gergely
|
PhD hallgató | publikációk | CV |
 ORMOS Pál
ORMOS Pál
|
emeritus kutatóprofesszor | publikációk |