
Kutatásaink fő célja a fotoszintetikus apparátus működésének megértése különböző szervezetekben és a szerkezeti és funkcionális kompolexitás különböző szintjein – különös tekintettel a dinamikus sajátságok és a gerjesztési energiaátadási, valamint az elektrontranszfer folyamatok közötti kölcsönhatásokra. Munkacsoportunk innovatív tudományos műszerek fejlesztésével és építésével is foglalkozik.
A protein komplexek és a tilakoidmembránok makroszerveződése és szerkezeti flexibilitása
Az elsődleges fotoszintetikus folyamatok mechanizmusai és dinamikája
Molekuláris kölcsönhatások a fotoszintetikus membránokban
Nem-kettősréteg lipidek és lipidfázisok szerkezeti és funkcionális szerepe tilakoidmembránokban
A második fotoszisztéma (PSII) fényadaptált töltésszétválasztott állapota
Mikroalgák biotechnológiai felhasználásához kapcsolódó vizsgálatok
Technikai fejlesztési projektek és alkalmazások
Korábbi cirkuláris dikroizmus (CD) spektroszkópiai vizsgálataink feltárták, hogy magasabb rendű növények és több algacsalád kloroplasztiszainak tilakoidmembránjaiban a pigment-protein komplexek kiterjedt, magasan szervezett királis makrodoméneket alkotnak, melynek köszönhetően a CD spektrumokban nagy erősségű, úgynevezett psi-típusú sávok jelennek meg (1. ábra). Ezen makrodomének szerkezete érzékenyen reagál a membránok fiziko-kémiai vagy a fotoszintetikus szervezetek környezeti változásaira (Garab 2014, Lambrev és Akhtar 2019). A makrodomének kialakulása magyarázza az LHCII:PSII és LHCI:PSI szuperkomplexek különválását és a membránok összetapadását, amely a gránumos ultrastruktúra önszerveződésének az alapja (Mustárdy és Garab 2003). Elektrontomográfiás vizsgálatok segítségével felfedtük a gránum-sztróma tilakoidmembrán rendszer kvázi-helikális szerkezetét (Mustárdy és mtsai. 2008).
A makroszkópikusan rendezett minták anizotrópikus CD-je (ACD) – amely a CD spektroszkópia egy kiterjesztése – a molekuláris orientációról ad kiegészítő információt. Az izolált állapotban vagy natív membránban lévő LHCII, csakúgy, mint az LHCII mikrokristályok, jól meghatározott ACD jellel rendelkeznek (Miloslavina és mtsai. 2012), amely geometriai korlátként szolgál segítve a specifikus klorofillok közötti exciton állapotok azonosítását (Akhtar és mtsai. 2019b).
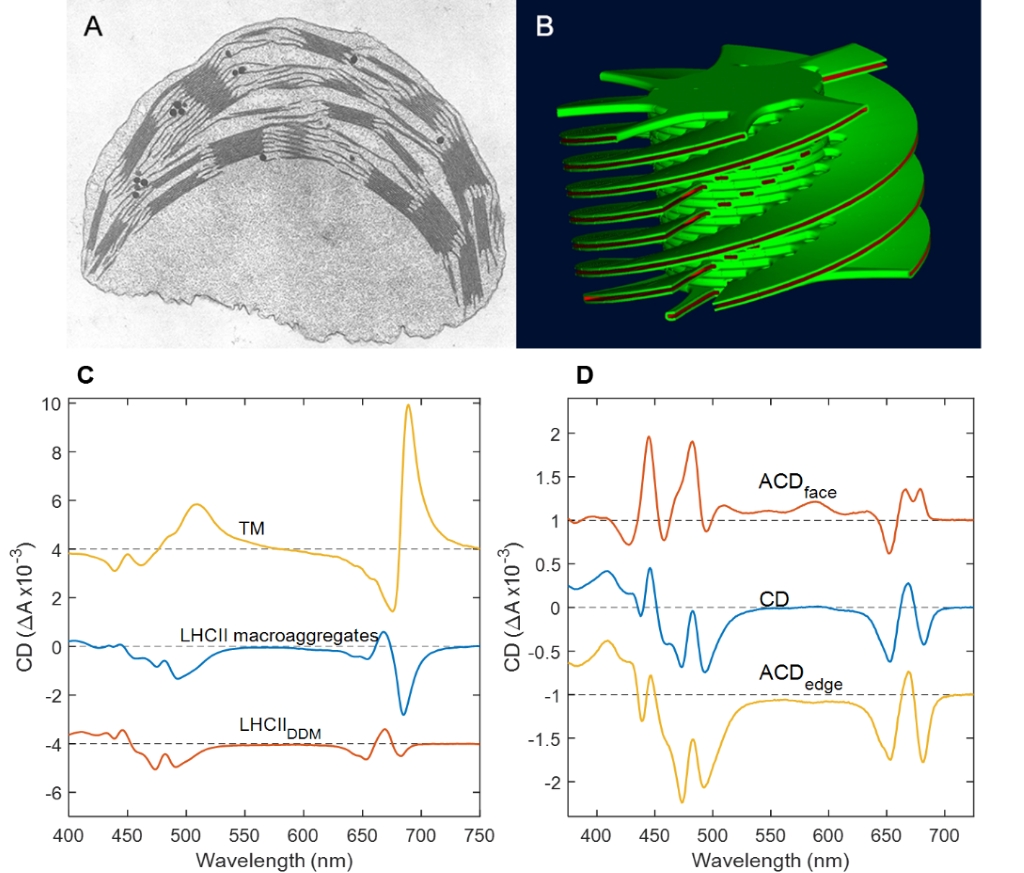
Tilakoidmembrán makroorganizációja: A. Magasabb rendű növényi kloroplasztisz vékony-metszet elektronmikroszkópos képe. B. gránumos tilakoidmembrán 3D modellje, amely sorozat-metszéses elektronmikroszkópos adatok alapján készült. C. borsó tilakoidmembránjának és LHCII lamelláris makroaggregátumainak psi-típusú CD spektruma, valamint a detergens-szolubilizált LHCII exciton CD spektruma. D. Lipid kettősrétegben orientált LHCII ACD spektruma (Mustárdy és Garab 2003, Lambrev és Akhtar 2019).
Kis-szögű neutronszórás (SANS) vizsgálataink – izolált tilakoidmembránokon, vad típusú és mutáns algasejteken és magasabb rendű növények levelein - megmutatták, hogy a tilakoidmembránok szerepe nem korlátozódik a fotoszintézis fényreakcióiban résztvevő komponensek beágyazására és a multilamelláris ultrastruktúra kialakítására; a fotoszintézis különböző regulációs folyamatait a membránszerkezet finomhangolása és karakterisztikus reverzibilis szerkezetváltozások kísérik (Nagy és mtsai. 2012, 2014, Ünnep és mtsai. 2014, Herdean és mtsai. 2016). Nem-invazív CD és SANS mérések segítségével jellemezzük a tilakoidmembránok mezoszkópikus méretskálán lejátszódó szerkezeti dinamikáját, amelynek révén fontos ismereteket szerezhetünk különböző élettanilag fontos folyamatok mechanizmusairól (Ünnep és mtsai. 2020, Nagy és Garab 2021).
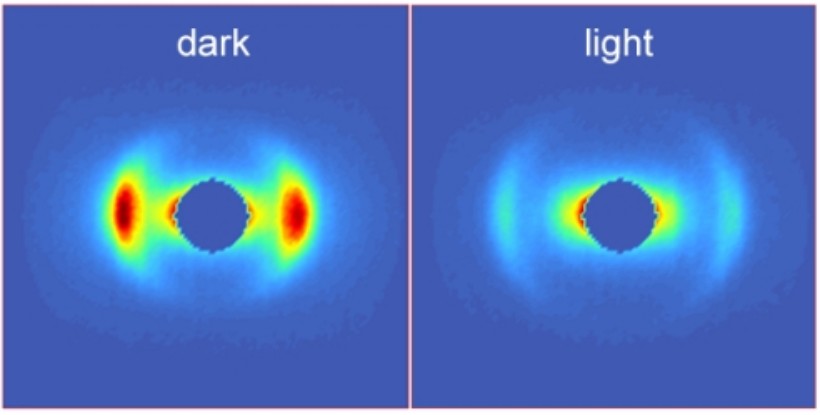
Izolált tilakoidmembránok kis-szögű neutronszórás profiljai sötétben és fehér fénnyel történt megvilágításukat követően.
Akhtar, P., Lindorfer, D., Lingvay, M., Pawlak, K., Zsiros, O., Siligardi, G., et al. (2019) Anisotropic circular dichroism of light-harvesting complex II in oriented lipid bilayers: Theory meets experiment. J. Phys. Chem. B 123: 1090–1098.
Garab, G. (2014) Hierarchical organization and structural flexibility of thylakoid membranes. Biochim Biophys Acta 1837: 481–494.
Lambrev, P.H. and Akhtar, P. (2019) Macroorganisation and flexibility of thylakoid membranes. Biochemical Journal 476: 2981–3018.
Lambrev, P.H., Akhtar, P. and Tan, H.-S. (2020) Insights into the mechanisms and dynamics of energy transfer in plant light-harvesting complexes from two-dimensional electronic spectroscopy. Biochim. Biophys. Acta 1861: 148050.
Mustárdy, L., Buttle, K., Steinbach, G. and Garab, G. (2008) The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly. Plant Cell 20: 2552–2557.
Mustárdy, L. and Garab, G. (2003) Granum revisited. A three-dimensional model – where things fall into place. Trends Plant Sci. 8: 117–122.
Ünnep, R., Zsiros, O., Solymosi, K., Kovács, L., Lambrev, P.H., Tóth, T., et al. (2014) The ultrastructure and flexibility of thylakoid membranes in leaves and isolated chloroplasts as revealed by small-angle neutron scattering. Biochim. Biophys. Acta. 1837: 1572–1580.
A fotoszintetikus apparátusban zajló fényelnyelés, gerjesztésienergia-vándorlás és fotokémiai töltésszétválasztás folyamatainak alapvető mechanizmusait, útvonalait és kinetikáját tanulmányozzuk. Különféle optikai spektroszkópiai módszerek alkalmazásával vizsgáljuk ezeket a reakciókat in vivo és in vitro - az izolált pigment–fehérje komplexektől a rekonstituált membránokig és ép sejtekig. Az ultragyors gerjesztési dinamikák követésére az egyik legalkalmasabb módszer a multidimenziós elektron spektroszkópia. Szoros együttműködésben dolgozunk együtt Howe-Siang Tan (NTU, Singapore) csoportjával, hogy új részleteket tárhassunk fel a fotoszintetikus fénybegyűjtés dinamikájáról ezen módszer segítségével (Lambrev és mtsai. 2019). 2-dimenziós elektron spektroszkópia segítségével egyidőben tudtuk követni az LHCII (Akhtar és mtsai. 2017) és a PSI (Akhtar és mtsai. 2018) “uphill” és “downhill” energiavándorlását. Felismertük, hogy az “uphill” energiavándorlás függ a hőmérséklettől, amely jól egyezik a termikus egyensúlyi kondíciókkal (Akhtar és mtsai. 2019, Akhtar és mtsai. 2020); ezek az “uphill” útvonalak gyors és hatékony energiavándorlást biztosítanak fiziológiás hőmérsékleten (Do és mtsai. 2019, Leng és mtsai. 2020).
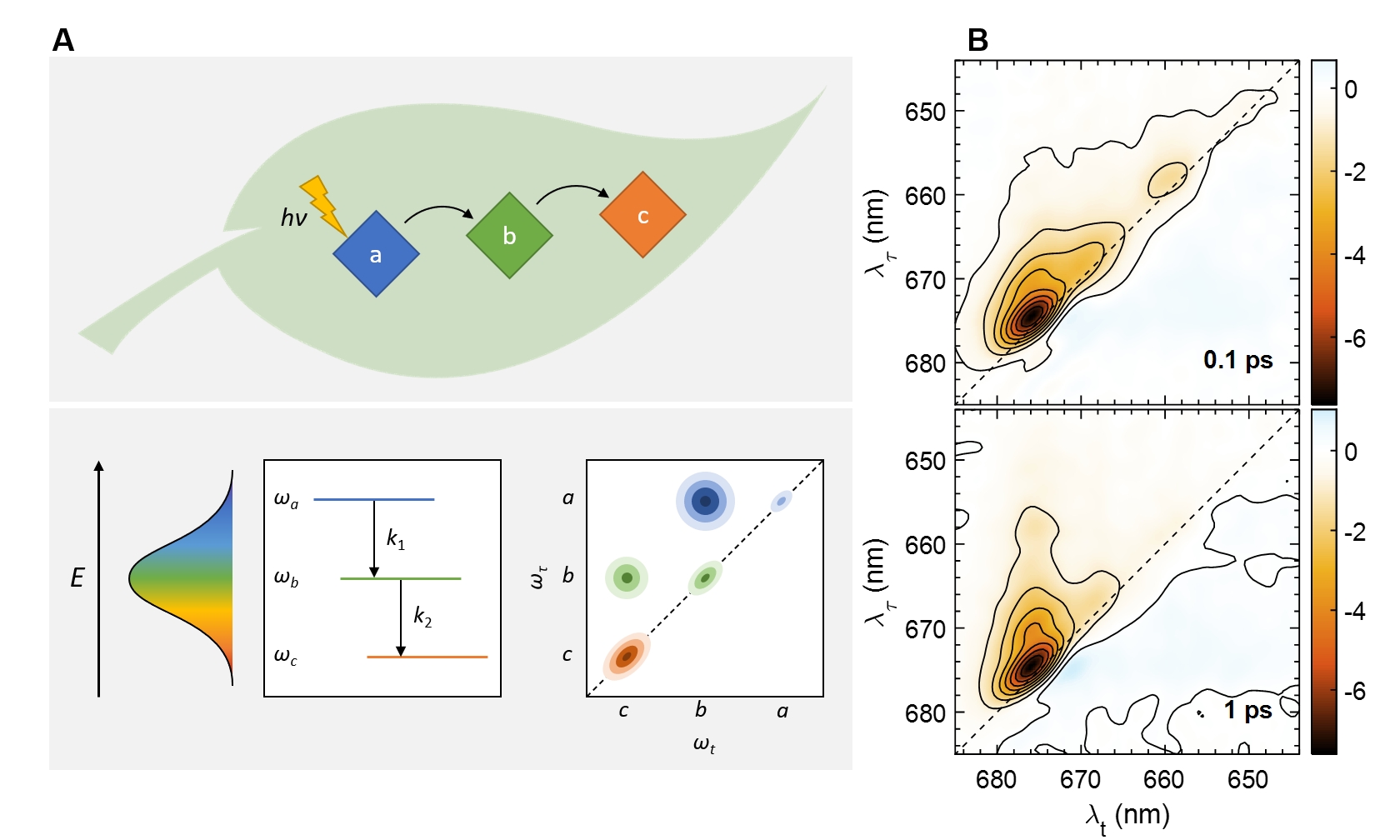
Fotoszintetikus komplexek energiatranszferjének vizsgálata 2-dimenziós elektron spektroszkópiával. A. A kapcsolt exciton átmenetek közötti relaxációk dinamikus keresztcsúcsokként jelennek meg a 2D spektrumban (Lambrev és mtsai. 2020). B. Bryopsis corticulans LHCII-jének 2D spektruma 77 K-n két különböző időpontban (Akhtar és mtsai. 2020b).
2 dimenziós elektron spektroszkópia és szerkezet-alapú elméleti modellezés ötvözésével követni tudtuk a cianobakteriális I. fotoszisztéma komplexek energiatranszferjének és töltésszétválasztásának dinamikáját 77 K-n és meghatároztuk, hogy direkt gerjesztés hatására a primér töltésszétválasztás körülbelül 1 ps alatt megy végbe a reakciócentrumban (Akhtar et al. 2021).
Akhtar, P., Caspy, I., Nowakowski, P.J., Malavath, T., Nelson, N., Tan, H.-S. and Lambrev, P.H. (2021) Two-dimensional electronic spectroscopy of a minimal Photosystem I complex reveals the rate of primary charge separation. Journal of the American Chemical Society 143: 14601–14612.
Akhtar, P., Do, T.N., Nowakowski, P.J., Huerta-Viga, A., Khyasudeen, M.F., Lambrev, P.H. and Tan, H.-S. (2019) Temperature dependence of the energy transfer in LHCII revealed by two-dimensional electronic spectroscopy. J. Phys. Chem. B 123: 6765–6775.
Akhtar, P. and Lambrev, P.H. (2020) On the spectral properties and excitation dynamics of long-wavelength chlorophylls in higher-plant photosystem I. Biochim. Biophys. Acta 1861: 148274.
Akhtar, P., Zhang, C., Do, T.N., Garab, G., Lambrev, P.H. and Tan, H.-S. (2017) Two-dimensional spectroscopy of chlorophyll a excited-state equilibration in light-harvesting complex II. J. Phys. Chem. Lett. 8: 257–263.
Akhtar, P., Zhang, C., Liu, Z., Tan, H.-S. and Lambrev, P.H. (2018) Excitation transfer and trapping kinetics in plant photosystem I probed by two-dimensional electronic spectroscopy. Photosynth. Res. 135: 239–250.
Do, T.N., Huerta-Viga, A., Akhtar, P., Nguyen, H.L., Nowakowski, P.J., Khyasudeen, M.F., et al. (2019) Revealing the excitation energy transfer network of Light-Harvesting Complex II by a phenomenological analysis of two-dimensional electronic spectra at 77 K. J. Chem. Phys. 151: 205101.
Lambrev, P.H., Akhtar, P. and Tan, H.-S. (2020) Insights into the mechanisms and dynamics of energy transfer in plant light-harvesting complexes from two-dimensional electronic spectroscopy. Biochim. Biophys. Acta 1861: 148050.
CD spektroszkópia segítségével megmutattuk, hogy az LHCII-ben zajló pigment-pigment kölcsönhatások érzékenyek a molekuláris környezetre (Lambrev és mtsai. 2007, Akhtar és mtsai. 2015). A komplexek membránokból történő kinyerése és detergens-szolubilizálása natív szerkezetük perturbációját vonja maga után. Ha az LHCII nem kötődik PSII szuperkomplexhez, energetikailag kapcsolt doméneket alkot (Lambrev és mtsai. 2011). Hasonló makroszerkezeti átrendeződések az LHC szupercsalád más antenna komplexeiben is megfigyelhetők, mint pl. az FCP a kovamoszatokban (Miloslavina és mtsai. 2009, Ghazaryan és mtsai. 2016). Modell membránokban az LHCII nagy sűrűségű klasztereket alkot (Tutkus és mtsai. 2019), ahol a gerjesztési állapot életideje fordítottan arányos a fehérje denzitásával (Akhtar és mtsai. 2019a). Ez a fajta gerjesztési kioltás az in vivo fotoprotektív nem-fotokémiai kioltáshoz hasonló spektroszkópiai jellemzőkkel bír, beleértve a klorofill-klorofill töltés-transzfer állapotok kialakulását, amely hatékonyan tudja a gerjesztési energiát disszipálni (Ostroumov és mtsai. 2020).
Lambrev, P., Várkonyi, Z., Krumova, S., Kovács, L., Miloslavina, Y., Holzwarth, A. R., and Garab, G. (2007) Importance of trimer–trimer interactions for the native state of the plant light-harvesting complex II. Biochim. Biophys. Acta - Bioenergetics 1767:847–853.
Akhtar, P., Dorogi, M., Pawlak, K., Kovács, L., Bóta, A., Kiss, T., Garab, G., and Lambrev, P.H. (2015) Pigment interactions in light-harvesting complex II in different molecular environments. J. Biol. Chem. 290:4877–4886.
Lambrev, P.H., Schmitt, F. J., Kussin, S., Schoengen, M., Várkonyi, Z., Eichler, H. J., Garab, G., and Renger, G. (2011) Functional domain size in aggregates of light-harvesting complex II and thylakoid membranes. Biochim. Biophys. Acta 1807:1022–1031.
Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., and Buchel, C. (2016) Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochim. Biophys. Acta - Bioenergetics 1857: 1373–1379.
Tutkus, M., Akhtar, P., Chmeliov, J., Görföl, F., Trinkunas, G., Lambrev, P. H., and Valkunas, L. (2018) Fluorescence microscopy of single liposomes with incorporated pigment–proteins. Langmuir 34:14410–14418.
Tutkus, M., Chmeliov, J., Trinkunas, G., Akhtar, P., Lambrev, P. H., and Valkunas, L. (2021) Aggregation-related quenching of LHCII fluorescence in liposomes revealed by single-molecule spectroscopy. J. Photoch. Photobio. B 218:112174.
Akhtar, P., Görföl, F., Garab, G., and Lambrev, P. H. (2019) Dependence of chlorophyll fluorescence quenching on the lipid-to-protein ratio in reconstituted light-harvesting complex II membranes containing lipid labels. Chem. Phys. 522:242–248.
Ostroumov, E. E., Götze, J. P., Reus, M., Lambrev, P. H., and Holzwarth, A. R. (2020) Characterization of fluorescent chlorophyll charge-transfer states as intermediates in the excited state quenching of light-harvesting complex II. Phot. Res. 144:171–193.
A dinamikus kicserőlédés membrán modellünk (DEM, Dynamic Exchange Model), amely a ’standard’ folyadék-mozaik, kettősréteg membrán modell kiterjesztése, magyarázatot ad a tilakoidmembrán (TM) kísérletileg bizonyított lipid polimorfizmusára és dinamikus sajátságaira. DEM szerint: (i) a nem-kettősréteg lipideket membránproteinek kényszerítik be (és tartják) a kettősréteg fázisba(n); (ii) a lipidek, magas nem-kettősréteg hajlamuknak köszönhetően ki is léphetnek kettősrétegből, azaz képesek szegregálódni a membránból; (iii) a TM lumen és sztróma vizes fázisai, magas fehérje koncentrációik mellett, tartalmaznak lipokalin és lipokalin-szerű fehérjéket, amelyek képesek lipid molekulákkal asszociálódni; (iv) a nem-kettősréteg lipidek és lipid fázisok, aktív részvételükkel fúziókban és elágazásokban, fontos szerepet játszanak a komplex vezikuláris TM rendszer önszerveződésében és szerkezetváltozásaiban. Ily módon a nem-kettősréteg lipidek jelenlétének köszönhető a TM önszabályozó homeosztázisa, biztosítva és szinten tartva a membrán magas protein:lipid arányát. Az utóbbi években végzett kísérleti adataink alapján megállapítottuk, hogy korábbi feltételezéseinkkel összhangban, a nem-kettősréteg lipidfázisok a fotoszintézis fényreakcióiért felelős szuperkomplexeket tartalmazó doménektől elkülönülő régiókban találhatók. Megmutattuk, hogy a lumenben taIálható, vízoldékony fotoprotektív lipokalin-szerű enzim, a VDE aktivitása az izotróp fázisok növekedéséhez kapcsolt; hasonló lipid:protein asszociátumok képződése valószínűsíthető más, lumen vagy sztróma oldali lipokalin vagy lipokalin-szerű vízoldékony proteinek részvételével. Megmutattuk, hogy a membránok fúziójában izotróp fázis(ok) vesz(nek) részt. Az invertált hexagonális (HII) fázis megjelenését sztróma oldali protein(ek) vagy polipeptid(ek) lipid-burkolatának tulajdonítjuk. További kutatásaink során szeretnénk tisztázni a különböző nem-kettősréteg lipid fázisok pontos természetét és kialakulásuk mechanizmusát vagy mechanizmusait, valamint szerepüket különböző regulációs folyamatokban és a TM energizálódásában.
|
|
|
A tilakoidmembrán lipid polimorfizmusa
Dlouhy, O., Karlicky, V., Javornik, U., Kurasova, I., Zsiros, O., Sket, P., et al. (2022) Lipid polymorphism of plant thylakoid membranes. Structural and functional units associated with non-bilayer phases. Biochim. Biophys. Acta 1863: 83-83.
Dlouhý, O., Kurasová, I., Karlický, V., Javornik, U., Šket, P., Petrova, N.Z., et al. (2020) Modulation of non-bilayer lipid phases and the structure and functions of thylakoid membranes: effects on the water-soluble enzyme violaxanthin de-epoxidase. Sci. Rep. 10: 11959.
Garab, G., Ughy, B., de Waard, P., Akhtar, P., Javornik, U., Kotakis, C., et al. (2017) Lipid polymorphism in chloroplast thylakoid membranes–as revealed by 31P-NMR and time-resolved merocyanine fluorescence spectroscopy. Sci. Rep. 7: 13343.
Garab, G., Yaguzhinsky, L.S., Dlouhý, O., Nesterov, S.V., Špunda, V. and Gasanoff, E.S. (2022) Structural and functional roles of non-bilayer lipid phases of chloroplast thylakoid membranes and mitochondrial inner membranes. Prog. Lipid Res. 86: 101163.
A PSII fényenergia segítségével képes a víz oxidálására, megteremtve és fenntartva bolygónk oxigénben dús atmoszféráját. A vízbontás révén a PSII biztosítja a bioszféra egészében felhasználható redukáló erőt. A változó klorofill fluoreszcencia (ChlF) a PSII aktivitásának követésére rutinszerűen alkalmazott technika. A ChlF legszélesebb körben elfogadott értelmezése szerint, amely az 1963-ban bevezetett modellre alapul, a PSII nyitott (PSIIO) és zárt (PSIIC) állapotokat vehet fel, a QA kinon elektronakceptor oxidált, ill. redukált állapotától függően. Korábbi vizsgálataink során sebességkorlátozó lépéseket fedeztünk fel a PSII sötét-fény átmenete során és feltártuk a zárt PSII fényadaptált (PSIIL) állapotának kialakulását, amelyben a töltésszétválasztott állapot jelentősen stabilabb, mint a PSIIC-ben. Megmutattuk továbbá, hogy a ChlF fizikai mechanizmusát új alapokra kell helyezni; ebben erős stacionárius és tranziens elektromos terek és dielektromos relaxációs folyamatok, valamint a RC mátrix lipidtartalma és protein-memóriát meghatározó tényezők játszanak jelentős szerepet. Kutatásainkat ezen területeken fejlett lézerspektroszkópiai szerkezet és molekuláris biológiai technikákkal folytatjuk. Bízunk benne, hogy ily módon mélyebb ismereteket szerezhetünk a fotoszintézis primér folyamatainak fizikai és molekuláris mechanizmusairól, melyek birtokában hatékony mesterséges fényenergia-hasznosító molekuláris szerkezetek állíthatók elő.
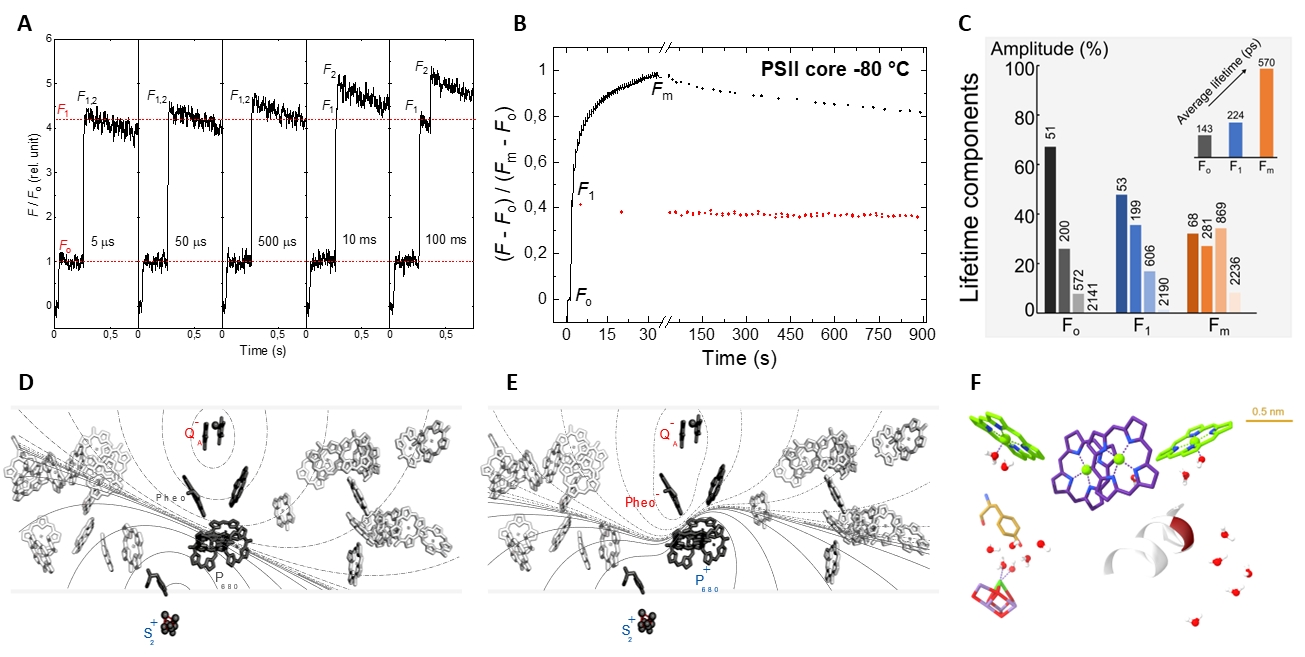
A legfontosabb új sajátságok a PSII sötét-fény átmenete során és a ChlF fizikai mechanizmusában. (A) Sebességkorlátozó lépések a PSII dupla-flash gerjesztése során; (B) a PSIIO–PSIIC–PSIIL többlépcsős átmenete, ahogy azt a ChlF the Fo–F1–Fm átmenete jelzi és a relaxációk alacsony hőmérsékleten; (C) a PSII fluoreszcencia élettartam komponensei; (D és F) stacionárius és tranziens elektromos terek ; és (F) erősen polarizálható csoportok a PSII-ben.
Garab, G., Magyar, M., Sipka, G. and Lambrev, P.H. (2023) Chlorophyll-a fluorescence induction on new grounds: quantum efficiency versus the light-adapted state of photosystem II. J. Exp. Bot. doi:10.1093/jxb/erad252
Magyar, M., Akhtar, P., Sipka, G., Han, W., Li, X., Han, G., et al. (2022) Dependence of the rate-limiting steps in the dark-to-light transition of photosystem II on the lipidic environment of the reaction center. Photosynthetica 60: 147-156.
Magyar, M., Sipka, G., Han, W., Li, X., Han, G., Shen, J.-R., et al. (2023) Characterization of the Rate-Limiting Steps in the Dark-To-Light Transitions of Closed Photosystem II: Temperature Dependence and Invariance of Waiting Times during Multiple Light Reactions. International Journal of Molecular Sciences 24: 94.
Magyar, M., Sipka, G., Kovács, L., Ughy, B., Zhu, Q., Han, G., et al. (2018) Rate-limiting steps in the dark-to-light transition of Photosystem II-revealed by chlorophyll-a fluorescence induction. Sci. Rep. 8: 2755.
Sipka, G., Magyar, M., Mezzetti, A., Akhtar, P., Zhu, Q., Xiao, Y., et al. (2021) Light-Adapted Charge-Separated State of Photosystem II: Structural and Functional Dynamics of the Closed Reaction Center. Plant Cell 33: 1286–1302.
Sipka, G., Nagy, L., Magyar, M., Akhtar, P., Shen, J.-R., Holzwarth, A.R., et al. (2022) Light-induced reversible reorganizations in closed Type II reaction centre complexes: physiological roles and physical mechanisms. Open Biology 12: 220297.
A mikroalgákat két szempontból érdemes tanulmányozni, egyrészt mint alapkutatás modell, másrészt mint ipari felhasználás tárgya, e kettő kiegészíti egymást. A mikroalgák sejtosztódására és stressz adaptációs folyamataira összpontosítunk, mert ezeken alapul a magas biomassza hozam és a bioaktív vegyületek termelése. A mikroalgák tanulmányozását különböző szinteken végezzük: gén, fehérje és szupra-individuális szinten. Eddigi kutatásaink azt mutatják, hogy egy egysejtű populációt egy kvázi szövetkén írhatunk le, ahol a populációt alkotó sejtek különböző differenciáltsági fokon vannak. Rávilágítottunk, hogy a populáció növekedése mindenképpen leáll; nem az éhezés következménye, mint ahogy a kolónia formáló készség elvesztése is genetikailag kódolt (Ughy és mtsai, 2023). A stacioner állapotban lévő populáció sejtjei csak egy bizonyos hígítás felett kezdenek el osztódni (minimal stationary cell concentration, MSCC). Ennek a tulajdonságnak fontos orvosi, és biotechnológiai következményei vannak (Ughy és mtsai, 2023) Vizsgáljuk a membrán szerkezetét és működését (Kóbori és mtsai, 2018). Kereskedelemben elérhető és saját, a természetes forrásokból izolált mikroalga törzsekkel foglalkozunk. A szelektált algakultúrák biotechnológiai felhasználáshoz kapcsolódó projektben veszünk részt, vizsgáljuk az algák takarmányozásban történő felhasználását, valamint az algák által termelt metabolitok egészségügyi felhasználását. Laboratóriumi körülmények között optimalizáljuk a mikroalgák szaporodását befolyásoló paramétereket. Az mikroalgák stressz körülmények között gyakran megnövekedett mennyiségű bioaktív vegyületet termelnek; kutatjuk a stressz adaptáció és bioaktív anyagok termelésének relációját (Kanna és mtsai, 2021). Tanulmányozzuk az individuális sejtosztódás alapvető molekuláris folyamatait és fehérjéit genetikai eszközökkel. Az individuális sejtosztódás molekuláris mechanizmusaival próbájuk magyarázni a sejtkultúrák különböző növekedési fázisait, vagyis kapcsolatot keresünk az egysejt osztódása és a populáció növekedése között. Vizsgálataink kiterjednek a mikroalgák növekedési paramétereinek, a fotoszintetikus folyamatok, valamint a zsírsav- és fehérjeösszetétel tanulmányozására is. Próbálunk önfenntartó baktérium konzorciumokat létrehozni, majd ezen tudás birtokában talajállag megóvását, javítását, illetve növénytermesztés fokozását tűztük ki célul.
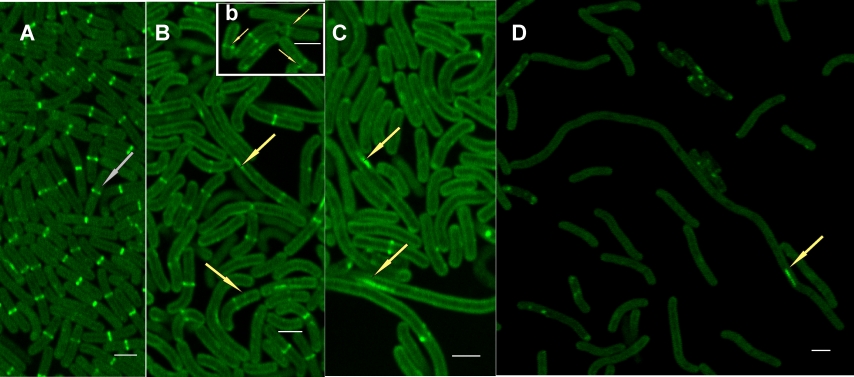
Az EGFP szignál mikroszkópos képe foszfatidilglicerin (PG) hiányos Synechococcus élő sejtekben, melyeket 4 napig PG jelenlétében (A) vagy PG nélkül neveltük 4 (B, b), 8 (C) és 12 napon át (D). (Kobori és mtsai. 2018).
Ughy, B., Nagyapati, S., Lajko, D. B., Letoha, T., Prohaszka, A., Deeb, D., Der, A., Pettko-Szandtner, A., and Szilak, L. (2023) Reconsidering Dogmas about the Growth of Bacterial Populations. Cells-Basel 12: 1430.
Kóbori, T. O., Uzumaki, T., Kis, M., Kovács, L., Domonkos, I., Itoh, S., Krynická, V., Kuppusamy, S. G., Zakar, T., Dean, J., Szilák, L., Komenda, J., Gombos, Z., and Ughy, B. (2018) Phosphatidylglycerol is implicated in divisome formation and metabolic processes of cyanobacteria, J. Plant Phys. 223:96–104.
Kanna, S. D., Domonkos, I., Kobori, T. O., Dergez, A., Bode, K., Nagyapati, S., Zsiros, O., Unnep, R., Nagy, G., Garab, G., Szilak, L., Solymosi, K., Kovacs, L., and Ughy, B. (2021) Salt Stress Induces Paramylon Accumulation and Fine-Tuning of the Macro-Organization of Thylakoid Membranes in Euglena gracilis Cells. Front. Plant. Sci. 12:725699.
Konfokális lézerpásztázó mikroszkópunkat (LSM) átalakítottuk differenciál-polarizációs lézerpásztázó mikroszkóppá (DP-LSM), amely a különböző polarizációs mennyiségek pixelről-pixelre történő mérésével lehetővé teszi a biológiai minták anizotróp molekuláris szerveződésének feltérképezését. A DP-LSM és Re-scan konfokális mikroszkóp a differenciál-polarizációs feltéttel (DP-RCM) az Euro-BioImaging network részei.
Az ELI-ALPS lézerközponttal (www.eli-alps.hu) való együttműködés keretein belül multidimenzionális optikai spektroszkópiai mérőállomást fejlesztünk, amely ultrarövid, ultraszélessávú pulzusokat alkalmaz nagyon magas ismétlési sebességgel.
UV-VIS abszorpció spektroszkópia (Thermo Evolution 500 kétsugaras spektrofotométer)
Cirkuláris és lineáris dikroizmus spektroszkópia (Jasco J-815 spektropolariméter hőmérséklet szabályozással, MCD, ACD)
Fluoreszcencia emisszió és gerjesztési spektrum (Jasco FP-8500 spektrofluorométer)
Pulse-amplitude modulated fluorométer (Walz)
Gyors fluoreszcencia indukciós mérések (Hansatech, PSI)
Flash-indukált fluoreszcencia változások, pump-probe fluoreszcencia mérések és relaxációs kinetikák egyénileg készített berendezéssel
Idő-korrelált egyfoton számláló spektrométer (PicoQuant FT200 + PicoHarp 300, állítható gerjesztés és emisszó 400-750 nm, 40 ps IRF FWHM, egyéni adat analízis lehetővé teszi a fluoreszcencia élettartam <10 ps felbontását)
Mikroszekundumos tranziens abszorpció és fluoreszcencia mérések – elektrokróm shift, P700, C550
Kisszögű neutron szórás (www.psi.ch, www.ill.eu, mlz-garching.de)
Szinkrotron-sugárzásos cirkuláris dikroizmus spektroszkópia (www.diamond.ac.uk)
Nukleáris mágneses rezonancia spektroszkópia (www.ceric-eric.eu)
Ultragyors spektroszkópia (www.laserlab-europe.eu, www.eli-alps.hu, www.eli-beams.eu)
Rendelkezünk egy vizes laborral, ahol a fehérje tisztítás, a membránok és fehérje komplexek helyreállítása, gél elektroforézis, stb. történik.
A laboratóriumban rendelkezésünkre állnak rázók és inkubátorok az algák és bakteriális sejtek neveléséhez; molekuláris biológiai módszerekhez szükséges műszerek; mikroszkóp; fehérje, lipid és zsírsav összetétel vizsgálathoz eszközök.
Devadasu, E., Kanna, S.D., Neelam, S., Yadav, R.M., Nama, S., Akhtar, P., et al. (2023) Long- and short-term acclimation of the photosynthetic apparatus to salinity in Chlamydomonas reinhardtii. The role of Stt7 protein kinase. Front. Plant Sci. 14.
Farkas, A., Pap, B., Zsiros, O., Patai, R., Shetty, P., Garab, G., et al. (2023) Salinity stress provokes diverse physiological responses of eukaryotic unicellular microalgae. Algal Research-Biomass Biofuels and Bioproducts 73.
Garab, G., Magyar, M., Sipka, G. and Lambrev, P.H. (2023) Chlorophyll-a fluorescence induction on new grounds: quantum efficiency versus the light-adapted state of photosystem II. J. Exp. Bot.
Jajoo, A., Subramanyam, R., Garab, G. and Allakhverdiev, S.I. (2023) Honoring two stalwarts of photosynthesis research: Eva-Mari Aro and Govindjee. Photosynth. Res. 157: 43-51.
Lambreva, M.D., Akhtar, P., Sipka, G., Margonelli, A. and Lambrev, P.H. (2023) Fluorescence quenching in thylakoid membranes induced by single-walled carbon nanotubes. Photochem. Photobiol. Sci.: 1–11.
Magyar, M., Sipka, G., Han, W., Li, X., Han, G., Shen, J.-R., et al. (2023) Characterization of the Rate-Limiting Steps in the Dark-To-Light Transitions of Closed Photosystem II: Temperature Dependence and Invariance of Waiting Times during Multiple Light Reactions. International Journal of Molecular Sciences 24: 94.
Ughy, B., Nagyapati, S., Lajko, D.B., Letoha, T., Prohaszka, A., Deeb, D., et al. (2023) Reconsidering Dogmas about the Growth of Bacterial Populations. Cells 12: 1430.
Akhtar, P., Biswas, A., Balog-Vig, F., Domonkos, I., Kovács, L. and Lambrev, P.H. (2022a) Trimeric Photosystem I facilitates energy transfer from phycobilisomes in Synechocystis PCC 6803. Plant Physiol. (In press).
Akhtar, P., Sipka, G., Han, W., Li, X., Han, G., Shen, J.-R., et al. (2022b) Ultrafast excitation quenching by the oxidized Photosystem II reaction center. J. Chem. Phys. (Under revision).
Dlouhy, O., Karlicky, V., Javornik, U., Kurasova, I., Zsiros, O., Sket, P., et al. (2022a) Lipid polymorphism of plant thylakoid membranes. Structural and functional units associated with non-bilayer phases. Biochim. Biophys. Acta 1863: 83-83.
Dlouhy, O., Karlicky, V., Javornik, U., Kurasova, I., Zsiros, O., Sket, P., et al. (2022b) Structural Entities Associated with Different Lipid Phases of Plant Thylakoid Membranes-Selective Susceptibilities to Different Lipases and Proteases. Cells 11.
Do, T.N., Nguyen, H.L., Akhtar, P., Zhong, K., Jansen, T.L.C., Knoester, J., et al. (2022) Ultrafast Excitation Energy Transfer Dynamics in the LHCII–CP29–CP24 Subdomain of Plant Photosystem II. J. Phys. Chem. Lett.: 4263-4271.
Garab, G., Yaguzhinsky, L.S., Dlouhý, O., Nesterov, S.V., Špunda, V. and Gasanoff, E.S. (2022) Structural and functional roles of non-bilayer lipid phases of chloroplast thylakoid membranes and mitochondrial inner membranes. Prog. Lipid Res. 86: 101163.
Magyar, M., Akhtar, P., Sipka, G., Han, W., Li, X., Han, G., et al. (2022) Dependence of the rate-limiting steps in the dark-to-light transition of photosystem II on the lipidic environment of the reaction center. Photosynthetica 60: 147-156.
Nagy, L., Magyar, M. (2022) No alternatives to photosynthesis: From molecules to nanostructures, In Agricultural Biocatalysis: Theoretical Studies and Photosynthesis Aspects (Jeschke, P.; Starikov, E. B., Eds.) 1 ed. 211–247, Jenny Stanford Publishing.
Pleckaitis, M., Habach, F., Kontenis, L., Steinbach, G., Jarockyte, G., Kalnaityte, A., et al. (2022) Structure and principles of self-assembly of giant “sea urchin” type sulfonatophenyl porphine aggregates. Nano Research 15: 5527–5537.
Rantala, M., Ivanauskaite, A., Laihonen, L., Kanna, S.D., Ughy, B. and Mulo, P. (2022) Chloroplast Acetyltransferase GNAT2 is Involved in the Organization and Dynamics of Thylakoid Structure. Plant Cell Physiol. 63: 1205-1214.
Sipka, G., Nagy, L., Magyar, M., Akhtar, P., Shen, J.-R., Holzwarth, A.R., et al. (2022) Light-induced reversible reorganizations in closed Type II reaction centre complexes: physiological roles and physical mechanisms. Open Biology 12: 220297.
Wang, H.Y., Qin, H., Garab, G. and Gasanoff, E.S. (2022) Short-Chained Alcohols Make Membrane Surfaces Conducive for Melittin Action: Implication for the Physiological Role of Alcohols in Cells. Cells 11.
Akhtar, P., Biswas, A., Kovacs, L., Nelson, N., and Lambrev, P. H. (2021) Excitation energy transfer kinetics of trimeric, monomeric and subunit-depleted Photosystem I from Synechocystis PCC 6803. Biochemical Journal 478: 1333–1346.
Akhtar, P., Caspy, I., Nowakowski, P.J., Malavath, T., Nelson, N., Tan, H.-S. and Lambrev, P.H. (2021) Two-dimensional electronic spectroscopy of a minimal Photosystem I complex reveals the rate of primary charge separation. Journal of the American Chemical Society 143: 14601–14612.
Gasanoff, E. S., Yaguzhinsky, L. S., and Garab, G. (2021) Cardiolipin, Non-Bilayer Structures and Mitochondrial Bioenergetics: Relevance to Cardiovascular Disease. Cells-Basel 10: 1721.
Kanna, S. D., Domonkos, I., Kobori, T. O., Dergez, A., Bode, K., Nagyapati, S., Zsiros, O., Unnep, R., Nagy, G., Garab, G., Szilak, L., Solymosi, K., Kovacs, L., and Ughy, B. (2021) Salt Stress Induces Paramylon Accumulation and Fine-Tuning of the Macro-Organization of Thylakoid Membranes in Euglena gracilis Cells. Front. Plant. Sci. 12: 725699.
Karlický, V., Kmecová Materová, Z., Kurasová, I., Nezval, J., Štroch, M., Garab, G., and Špunda, V. (2021) Accumulation of geranylgeranylated chlorophylls in the pigment-protein complexes of Arabidopsis thaliana acclimated to green light: effects on the organization of light-harvesting complex II and photosystem II functions. Photosynthesis Research 149: 233–252.
Lambrev, P. H., Akhtar, P., and Garab, G. (2021) Plasticity of Photosystem II. Fine-Tuning of the Structure and Function of Light-Harvesting Complex II and the Reaction Center, In Photosynthesis: Molecular Approaches to Solar Energy Conversion (Shen, J.-R., and Satoh, K., and Allakhverdiev, S. I., Eds.) 1 ed. 375–393, Springer.
Nguyen, H. L., Do, T. N., Akhtar, P., Jansen, T. L., Knoester, J., Wang, W., Shen, J.-R., Lambrev, P. H., and Tan, H.-S. (2021) An Exciton Dynamics Model of Bryopsis corticulans Light-Harvesting Complex II. The Journal of Physical Chemistry B 125: 1134–1143.
Patty, C. H. L., Kühn, J. G., Lambrev, P. H., Spadaccia, S., Jens Hoeijmakers, H., Keller, C., Mulder, W., Pallichadath, V., Poch, O., Snik, F., Stam, D. M., Pommerol, A., and Demory, B.-O. (2021) Biosignatures of the Earth. A&A 651: A68.
Radosavljevic, J. S., Mitrovic, A. L., Radotic, K., Zimanyi, L., Garab, G., and Steinbach, G. (2021) Differential Polarization Imaging of Plant Cells. Mapping the Anisotropy of Cell Walls and Chloroplasts. Int J Mol Sci 22: 7661.
Sipka, G., Magyar, M., Mezzetti, A., Akhtar, P., Zhu, Q., Xiao, Y., Han, G., Santabarbara, S., Shen, J.-R., Lambrev, P. H., and Garab, G. (2021) Light-Adapted Charge-Separated State of Photosystem II: Structural and Functional Dynamics of the Closed Reaction Center. The Plant Cell 33: 1286–1302.
Tutkus, M., Chmeliov, J., Trinkunas, G., Akhtar, P., Lambrev, P.H. and Valkunas, L. (2021) Aggregation-related quenching of LHCII fluorescence in liposomes revealed by single-molecule spectroscopy. J. Photochem. Photobiol. B: Biol. 218: 112174.
Akhtar P, Biswas A, Petrova N, Zakar T, van Stokkum IHM, Lambrev PH (2020) Time-resolved fluorescence study of excitation energy transfer in the cyanobacterium Anabaena PCC 7120. Photosynth Res 144 (2):247–259.
Akhtar P, Nowakowski PJ, Wang W, Do TN, Zhao S, Siligardi G, Garab G, Shen JR, Tan HS, Lambrev PH (2020) Spectral tuning of light-harvesting complex II in the siphonous alga Bryopsis corticulans and its effect on energy transfer dynamics. Biochim Biophys Acta Bioenerg 1861 (7):148191.
Akhtar P, Lambrev P (2020) On the spectral properties and excitation dynamics of long-wavelength chlorophylls in higher-plant photosystem I. Biochim Biophys Acta Bioenerg 1861 (11):148274.
Bernula D, Benkő P, Kaszler N, Domonkos I, Valkai I, Szőllősi R, Ferenc G, Ayaydin F, Fehér A, Gémes K (2020) Timely removal of exogenous cytokinin and the prevention of auxin transport from the shoot to the root affect the regeneration potential of Arabidopsis roots. Plant Cell, Tissue and Organ Culture (PCTOC) 140 (2):327–339.
Biswas A, Huang X, Lambrev PH, van Stokkum IHM (2020) Modelling excitation energy transfer and trapping in the filamentous cyanobacterium Anabaena variabilis PCC 7120. Photosynth Res 144 (2):261–272.
Dlouhy O, Kurasova I, Karlicky V, Javornik U, Sket P, Petrova N Z, Krumova S B, Plavec J, Ughy B, Spunda V, Garab G (2020) Modulation of non-bilayer lipid phases and the structure and functions of thylakoid membranes: effects on the water-soluble enzyme violaxanthin de-epoxidase. Sci Rep 10 (1): 11959.
Lambrev PH, Akhtar P, Tan H-S (2020) Insights into the mechanisms and dynamics of energy transfer in plant light-harvesting complexes from two-dimensional electronic spectroscopy. Biochim Biophys Acta 1861 (4):148050.
Leng X, Do TN, Akhtar P, Nguyen HL, Lambrev P, Tan HS (2020) Hierarchical Equations of Motion Simulation of Temperature-Dependent Two-Dimensional Electronic Spectroscopy of the Chlorophyll a Manifold in LHCII. Chem Asian J in press.
Lingvay M, Akhtar P, Sebok-Nagy K, Pali T, Lambrev P (2020) Photobleaching of Chlorophyll in Light-Harvesting Complex II Increases in Lipid Environment. Front Plant Sci 849 (11):14 p.
Nagy, G., and Garab, G. (2020) Neutron scattering in photosynthesis research: recent advances and perspectives for testing crop plants, Photosynthesis Research 150: 41–49.
Ostroumov EE, Gotze JP, Reus M, Lambrev PH, Holzwarth AR (2020) Characterization of fluorescent chlorophyll charge-transfer states as intermediates in the excited state quenching of light-harvesting complex II. Photosynth Res 144 (2):171–193.
Ünnep R, Paul S, Zsiros O,Kovács L, Székely NK, Steinbach G, Appavou M-S, Porcar L, Holzwarth AR, Garab G, Nagy G (2020) Thylakoid membrane reorganizations revealed by small-angle neutron scattering of Monstera deliciosa leaves associated with non-photochemical quenching. Open biol 200144 , 12 p.
Wientjes E, Lambrev P (2020) Ultrafast processes in photosynthetic light-harvesting. Photosynth Res 144 (2):123–125.
Wilhelm, C., Goss, R., and Garab, G. (2020) The fluid-mosaic membrane theory in the context of photosynthetic membranes: Is the thylakoid membrane more like a mixed crystal or like a fluid?. J Plant Physiol 252: 153246.
Zsiros O, Ünnep R, Nagy G, Almasy L, Patai R, Szekely NK, Kohlbrecher J, Garab G, Der A, Kovacs L (2020) Role of Protein-Water Interface in the Stacking Interactions of Granum Thylakoid Membranes-As Revealed by the Effectsof Hofmeister Salts. Front Plant Sci 1257 (11):14 p.
Zsiros O, Nagy G, Patai R, Solymosi K, Gasser U, Polgar TF, Garab G, Kovacs L, Horcsik ZT (2020) Similarities and Differences in the Effects of Toxic Concentrations of Cadmium and Chromium on the Structure and Functions of Thylakoid Membranes in Chlorella variabilis. Front Plant Sci 1006, 13 p.
Akhtar P, Do TN, Nowakowski PJ, Huerta-Viga A, Khyasudeen MF, Lambrev PH, Tan HS (2019) Temperature Dependence of the Energy Transfer in LHCII Studied by Two-Dimensional Electronic Spectroscopy. J Phys Chem B 123 (31):6765–6775.
Akhtar P, Gorfol F, Garab G, Lambrev PH (2019) Dependence of chlorophyll fluorescence quenching on the lipid-to-protein ratio in reconstituted light-harvesting complex II membranes containing lipid labels. Chem Phys 522:242–248.
Akhtar P, Lindorfer D, Lingvay M, Pawlak K, Zsiros O, Siligardi G, Javorfi T, Dorogi M, Ughy B, Garab G, Renger T, Lambrev PH (2019) Anisotropic Circular Dichroism of Light-Harvesting Complex II in Oriented Lipid Bilayers: Theory Meets Experiment. J Phys Chem B 123 (5):1090–1098.
Bocsik A, Grof I, Kiss L, Otvos F, Zsiros O, Daruka L, Fulop L, Vastag M, Kittel A, Imre N, Martinek TA, Pal C, Szabo-Revesz P, Deli MA (2019) Dual Action of the PN159/KLAL/MAP Peptide: Increase of Drug Penetration across Caco-2 Intestinal Barrier Model by Modulation of Tight Junctions and Plasma Membrane Permeability. Pharmaceutics 11 (2):73.
Do TN, Huerta-Viga A, Akhtar P, Nguyen HL, Nowakowski PJ, Khyasudeen MF, Lambrev PH, Tan H-S (2019) Revealing the excitation energy transfer network of Light-Harvesting Complex II by a phenomenological analysis of two-dimensional electronic spectra at 77 K. J Chem Phys 151 (20):205101.
Hudak A, Kusz E, Domonkos I, Josvay K, Kodamullil AT, Szilak L, Hofmann-Apitius M, Letoha T (2019) Contribution of syndecans to cellular uptake and fibrillation of alpha-synuclein and tau. Scientific Reports 9:16543.
Lambrev PH, Akhtar P (2019) Macroorganisation and flexibility of thylakoid membranes. Biochem J 476 (20):2981–3018.
Letoha T, Hudak A, Kusz E, Pettko-Szandtner A, Domonkos I, Josvay K, Hofmann-Apitius M, Szilak L (2019) Contribution of syndecans to cellular internalization and fibrillation of amyloid-beta(1-42). Scientific Reports 9 (1):1393.
Patty CHL, ten Kate IL, Buma WJ, van Spanning RJM, Steinbach G, Ariese F, Snik F (2019) Circular Spectropolarimetric Sensing of Vegetation in the Field: Possibilities for the Remote Detection of Extraterrestrial Life. Astrobiology 19 (10):1221–1229.
Sipka G, Muller P, Brettel K, Magyar M, Kovacs L, Zhu QJ, Xiao YA, Han GY, Lambrev PH, Shen JR, Garab G (2019) Redox transients of P680 associated with the incremental chlorophyll-a fluorescence yield rises elicited by a series of saturating flashes in diuron-treated photosystem II core complex of Thermosynechococcus vulcanus. Physiol Plant 166 (1):22–32.
Steinbach G, Nagy D, Sipka G, Manders E, Garab G, Zimanyi L (2019) Fluorescence-detected linear dichroism imaging in a re-scan confocal microscope equipped with differential polarization attachment. Eur Biophys J 48 (5):457–463.
Ughy B, Karlicky V, Dlouhy O, Javornik U, Materova Z, Zsiros O, Sket P, Plavec J, Spunda V, Garab G (2019) Lipid-polymorphism of plant thylakoid membranes. Enhanced non-bilayer lipid phases associated with increased membrane permeability. Physiol Plant 166 (1):278–287.
Ughy B, Schmidthoffer I, Szilak L (2019) Heparan sulfate proteoglycan (HSPG) can take part in cell division: inside and outside. Cell Mol Life Sci 76 (5):865–871.
Zsiros O, Nagy V, Párducz Á, Nagy G, Ünnep R, El-Ramady H, Prokisch J, Lisztes-Szabó Z, Fári M, Csajbók J, Tóth SZ, Garab G, Domokos-Szabolcsy É (2019) Effects of selenate and red Se-nanoparticles on the photosynthetic apparatus of Nicotiana tabacum. Photosynth Res 139 (1):449-460.
Akhtar P, Zhang C, Liu Z, Tan HS, Lambrev PH (2018) Excitation transfer and trapping kinetics in plant photosystem I probed by two-dimensional electronic spectroscopy. Photosynth Res 135 (1–3):239–250.
Domokos-Szabolcsy É, Fári M, Márton L, Czakó M, Veres S, Elhawat N, Antal G, El-Ramady H, Zsíros O, Garab G (2018) Selenate tolerance and selenium hyperaccumulation in the monocot giant reed (Arundo donax), a biomass crop plant with phytoremediation potential. Environ Sci Pollut Res 25 (31):31368–31380.
Erdei AI, Borbely A, Magyar A, Taricska N, Perczel A, Zsiros O, Garab G, Szucs E, Otvos F, Zador F, Balogh M, Al-Khrasani M, Benyhe S (2018) Biochemical and pharmacological characterization of three opioid-nociceptin hybrid peptide ligands reveals substantially differing modes of their actions. Peptides 99:205–216.
Kis M, Sipka G, Ayaydin F, Maroti P (2018) The biophysics of a critical phenomenon: colonization and sedimentation of the photosynthetic bacteria Rubrivivax gelatinosus. Eur Biophys J 47 (2):139–149.
Kóbori TO, Uzumaki T, Kis M, Kovács L, Domonkos I, Itoh S, Krynická V, Kuppusamy SG, Zakar T, Dean J, Szilák L, Komenda J, Gombos Z, Ughy B (2018) Phosphatidylglycerol is implicated in divisome formation and metabolic processes of cyanobacteria. J Plant Physiol 223:96–104.
Kotakis C, Akhtar P, Zsiros O, Garab G, Lambrev PH (2018) Increased thermal stability of photosystem II and the macro-organization of thylakoid membranes, induced by co-solutes, associated with changes in the lipid-phase behaviour of thylakoid membranes. Photosynthetica.
Magyar M, Sipka G, Kovács L, Ughy B, Zhu Q, Han G, Špunda V, Lambrev PH, Shen J-R, Garab G (2018) Rate-limiting steps in the dark-to-light transition of Photosystem II - revealed by chlorophyll-a fluorescence induction. Scientific Reports 8 (1):2755.
Nedzved A, Mitrović AL, Savić A, Mutavdžić D, Radosavljević JS, Pristov JB, Steinbach G, Garab G, Starovoytov V, Radotić K (2018) Automatic image processing morphometric method for the analysis of tracheid double wall thickness tested on juvenile Picea omorika trees exposed to static bending. Trees 32 (5):1347–1356.
Patty CL, Luo DA, Snik F, Ariese F, Buma WJ, Ten Kate IL, van Spanning RJ, Sparks WB, Germer TA, Garab G (2018) Imaging linear and circular polarization features in leaves with complete Mueller matrix polarimetry. Biochimica et Biophysica Acta (BBA) - General Subjects 1862 (6):1350–1363.
Sipka G, Kis M, Maroti P (2018) Characterization of mercury(II)-induced inhibition of photochemistry in the reaction center of photosynthetic bacteria. Photosynth Res. 136: 379–392.
Sipka G, Kis M, Smart JL, Maróti P (2018) Fluorescence induction of photosynthetic bacteria. Photosynthetica 56 (1):125–131.
Sipka G, Maroti P (2018) Photoprotection in intact cells of photosynthetic bacteria: quenching of bacteriochlorophyll fluorescence by carotenoid triplets. Photosynth Res 136 (1):17–30.
Stefanov D, Milanov G, Lambrev P, Kurteva M, Abumhadi N, Goltsev V, Kapchina V (2018) Delayed fluorescence measurements show increased S2QB− charge recombination in PS2 of tobacco pigment-deficient aurea mutant. Comptes Rendus de L'Academie Bulgare des Sciences 71 (8):1052–1061.
Tutkus M, Akhtar P, Chmeliov J, Görföl F, Trinkunas G, Lambrev PH, Valkunas L (2018) Fluorescence Microscopy of Single Liposomes with Incorporated Pigment–Proteins. Langmuir 34 (47):14410–14418.
Akhtar P, Zhang C, Do TN, Garab G, Lambrev PH, Tan H-S (2017) Two-dimensional spectroscopy of chlorophyll a excited-state equilibration in light-harvesting complex II. J Phys Chem Lett 8 (1):257–263.
Bar Eyal L, Ranjbar Choubeh R, Cohen E, Eisenberg I, Tamburu C, Dorogi M, Unnep R, Appavou MS, Nevo R, Raviv U, Reich Z, Garab G, van Amerongen H, Paltiel Y, Keren N (2017) Changes in aggregation states of light-harvesting complexes as a mechanism for modulating energy transfer in desert crust cyanobacteria. Proceedings of the National Academy of Sciences 114 (35):9481–9486.
Garab G, Ughy B, de Waard P, Akhtar P, Javornik U, Kotakis C, Sket P, Karlicky V, Materova Z, Spunda V, Plavec J, van Amerongen H, Vigh L, Van As H, Lambrev PH (2017) Lipid polymorphism in chloroplast thylakoid membranes - as revealed by 31P-NMR and timeresolved merocyanine fluorescence spectroscopy. Scientific Reports 7 (1):13343.
Keller-Pinter A, Ughy B, Domoki M, Pettko-Szandtner A, Letoha T, Tovari J, Timar J, Szilak L (2017) The phosphomimetic mutation of syndecan-4 binds and inhibits Tiam1 modulating Rac1 activity in PDZ interaction-dependent manner. PLoS One 12 (11):e0187094.
Radosavljevic JS, Pristov JB, Mitrovic AL, Steinbach G, Mouille G, Tufegdzic S, Maksimovic V, Mutavdzic D, Janosevic D, Vukovic M, Garab G, Radotic K (2017) Parenchyma cell wall structure in twining stem of Dioscorea balcanica. Cellulose 24 (11):4653–4669.
Szabo T, Cseko R, Hajdu K, Nagy K, Sipos O, Galajda P, Garab G, Nagy L (2017) Sensing photosynthetic herbicides in an electrochemical flow cell. Photosynth Res 132 (2):127–134.
Unnep R, Zsiros O, Horcsik Z, Marko M, Jajoo A, Kohlbrecher J, Garab G, Nagy G (2017) Low-pH induced reversible reorganizations of chloroplast thylakoid membranes - As revealed by small-angle neutron scattering. Bba-Bioenergetics 1858 (5):360–365.
Akhtar P, Lingvay M, Kiss T, Deák R, Bóta A, Ughy B, Garab G, Lambrev PH (2016) Excitation energy transfer between light-harvesting complex II and photosystem I in reconstituted membranes. Biochim Biophys Acta 1857 (4):462–472.
Garab G (2016) Self-assembly and structural–functional flexibility of oxygenic photosynthetic machineries: personal perspectives. Photosynth Res 127 (1):131-150.
Garab G, Ughy B, Goss R (2016) Role of MGDG and Non-bilayer Lipid Phases in the Structure and Dynamics of Chloroplast Thylakoid Membranes. In: Nakamura Y, Li-Beisson Y (eds) Lipids in Plant and Algae Development. Springer, Dordrecht, pp 127–157. doi:10.1007/978-3-319-25979-6
Ghazaryan A, Akhtar P, Garab G, Lambrev PH, Buchel C (2016) Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochim Biophys Acta 1857 (9):1373–1379.
Herdean A, Nziengui H, Zsiros O, Solymosi K, Garab G, Lundin B, Spetea C (2016a) The Arabidopsis Thylakoid Chloride Channel AtCLCe Functions in Chloride Homeostasis and Regulation of Photosynthetic Electron Transport. Front Plant Sci 7:115.
Herdean A, Teardo E, Nilsson AK, Pfeil BE, Johansson ON, Unnep R, Nagy G, Zsiros O, Dana S, Solymosi K, Garab G, Szabo I, Spetea C, Lundin B (2016b) A voltage-dependent chloride channel fine-tunes photosynthesis in plants. Nat Commun 7:11654.
Nielsen JT, Kulminskaya NV, Bjerring M, Linnanto JM, Ratsep M, Pedersen MO, Lambrev PH, Dorogi M, Garab G, Thomsen K, Jegerschold C, Frigaard NU, Lindahl M, Nielsen NC (2016) In situ high-resolution structure of the baseplate antenna complex in Chlorobaculum tepidum. Nat Commun 7:12454.
Tóth TN, Rai N, Solymosi K, Zsiros O, Schröder WP, Garab G, van Amerongen H, Horton P, Kovács L (2016) Fingerprinting the macro-organisation of pigment-protein complexes in plant thylakoid membranes in vivo by circular-dichroism spectroscopy. Biochimica et Biophysica Acta-Bioenergetics 1857 (9):1479–1489.
Akhtar P, Dorogi M, Pawlak K, Kovacs L, Bota A, Kiss T, Garab G, Lambrev PH (2015) Pigment interactions in light-harvesting complex II in different molecular environments. J Biol Chem 290 (8):4877–4886.
Bricker WP, Shenai PM, Ghosh A, Liu Z, Enriquez MG, Lambrev PH, Tan HS, Lo CS, Tretiak S, Fernandez-Alberti S, Zhao Y (2015) Non-radiative relaxation of photoexcited chlorophylls: theoretical and experimental study. Sci Rep 5:13625.
Enriquez MM, Akhtar P, Zhang C, Garab G, Lambrev PH, Tan HS (2015) Energy transfer dynamics in trimers and aggregates of light-harvesting complex II probed by 2D electronic spectroscopy. J Chem Phys 142 (21):212432.
Karlsson PM, Herdean A, Adolfsson L, Beebo A, Nziengui H, Irigoyen S, Unnep R, Zsiros O, Nagy G, Garab G, Aronsson H, Versaw WK, Spetea C (2015) The Arabidopsis thylakoid transporter PHT4;1 influences phosphate availability for ATP synthesis and plant growth. Plant J 84 (1):99–110.
Nagy L, Kiss V, Brumfeld V, Osvay K, Borzsonyi A, Magyar M, Szabo T, Dorogi M, Malkin S (2015) Thermal Effects and Structural Changes of Photosynthetic Reaction Centers Characterized by Wide Frequency Band Hydrophone: Effects of Carotenoids and Terbutryn. Photochem Photobiol 91 (6):1368–1375.
Szabo T, Magyar M, Hajdu K, Dorogi M, Nyerki E, Toth T, Lingvay M, Garab G, Hernadi K, Nagy L (2015) Structural and Functional Hierarchy in Photosynthetic Energy Conversion-from Molecules to Nanostructures. Nanoscale Res Lett 10 (1):458.
Toth TN, Chukhutsina V, Domonkos I, Knoppova J, Komenda J, Kis M, Lenart Z, Garab G, Kovacs L, Gombos Z, van Amerongen H (2015) Carotenoids are essential for the assembly of cyanobacterial photosynthetic complexes. Biochim Biophys Acta 1847 (10):1153–1165.
Zhang Z, Lambrev PH, Wells KL, Garab G, Tan HS (2015) Direct observation of multistep energy transfer in LHCII with fifth-order 3D electronic spectroscopy. Nat Commun 6:7914.
Demmig-Adams, B., Garab, G. & Adams III, W. (Eds) (2014) Non-Photochemical Quenching and Energy Dissipation in Plants, Algae and Cyanobacteria. Adv. Photosynth. Respir., Vol. 40, Springer Science+Business Media, Dordrecht
Garab, G. (2014) Hierarchical organization and structural flexibility of thylakoid membranes. Biochim. Biophys. Acta 1837: 481-494.
Hind, G., Wall, J.S., Várkonyi, Z., Istokovics, A., Lambrev, P.H. & Garab, G. (2014) Membrane crystals of plant light-harvesting complex II disassemble reversibly in light. Plant Cell Physiol. 55: 1296-303.
Nagy, G., Ünnep, R., Zsiros, O., Tokutsu, R., Takizawa, K., Porcar, L., Moyet, L., Petroutsos, D., Garab, G., Finazzi, G. & Minagawa, J. (2014) Chloroplast remodeling during state transitions in Chlamydomonas reinhardtii as revealed by non-invasive techniques in vivo, Proc. Natl. Acad. Sci. USA, 111: 5042-5047.
Ünnep, R., Zsiros, O., Solymosi, K., Kovács, L., Lambrev, P.H., Tóth, T., Schweins, R., Posselt, D., Székely, N.K., Rosta, L., Nagy, G. & Garab G. (2014) The ultrastructure and flexibility of thylakoid membranes in leaves and isolated chloroplasts as revealed by small-angle neutron scattering. Biochim. Biophys. Acta 1837: 1572-1580.
Wells, K.L., Lambrev, P.H., Zhang, Z., Garab, G. & Tan, H.S. (2014) Pathways of energy transfer in LHCII revealed by room-temperature 2D electronic spectroscopy, Phys. Chem. Chem. Phys. 16: 1463-9076.
Lambrev, P.H., Miloslavina, Y., Van Stokkum, I.H.M., Stahl, A.D., Michalik, M., Susz, A., Tworzydło, J., Fiedor, J., Huhn, G., Groot, M.L., Van Grondelle, R., Garab, G. & Fiedor, L. (2013) Excitation energy trapping and dissipation by Ni-substituted bacteriochlorophyll a in reconstituted LH1 complexes from Rhodospirillum rubrum. J. Phys. Chem. B 117: 11260-11271.
Lambrev, P.H. & Miloslavina, Y. (2012) On the relationship between non-photochemical quenching and photoprotection of Photosystem II. Biochim. Biophys. Acta 1817: 760–769.
Nagy, G., Szabó, M., Ünnep, R., Káli, G., Miloslavina, Y., Lambrev, P.H., Zsiros, O., Porcar, L., Timmins, P., Rosta, L. & Garab, G. (2012) Modulation of the multilamellar membrane organization and of the chiral macrodomains in the diatom revealed by small-angle neutron scattering and circular dichroism spectroscopy. Photosynth. Res. 111: 71-79.
Lambrev, P.H., Schmitt, F.J., Kussin, S., Schoengen, M., Várkonyi, Zs., Eichler, H.J., Garab, G. & Renger G. (2011) Functional domain size in aggregates of light-harvesting complex II and thylakoid membranes. Biochim. Biophys. Acta 1807: 1022-1031.
Miloslavina, Y., Lambrev, P.H., Jávorfi, T., Várkonyi, Zs., Karlický, V., Wall, J.S., Hind, G. & Garab, G. (2011) Anisotropic circular dichroism signatures of oriented thylakoid membranes and lamellar aggregates of LHCII. Photosynth. Res. 111: 29-39.
Schansker, G., Tóth, S.Z., Kovács, L., Holzwarth, A.R. & Garab, G. (2011) Evidence for a fluorescence yield change driven by a light-induced conformational change within photosystem II during the fast chlorophyll a fluorescence rise. Biochim. Biophys. Acta 1807: 1032-1043.
Krumova, S.B., Laptenok, S.P., Kovács, L., Tóth, T., van Hoek, A., Garab, G. & van Amerongen, H. (2010) Digalactosyl-diacylglycerol-deficiency lowers the thermal stability of thylakoid membranes. Photosynth. Res. 105: 229-242.
Miloslavina, Y., Grouneva, I., Lambrev, P.H., Lepetit, B., Goss, R., Wilhelm, C. & Holzwarth, A.R. (2009) Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochim. Biophys. Acta 1787: 1189-1197.
Krumova, S.B., Koehorst, R.B.M., Bóta, A., Páli, T., van Hoek, A., Garab, G. & van Amerongen, H. (2008) Temperature dependence of the lipid packing in thylakoid membranes studied by time-and spectrally resolved fluorescence of Merocyanine 540. Biochim. Biophys. Acta 1778: 2823-2833.
Miloslavina, Y., Wehner, A., Lambrev, P.H., Wientjes, E., Reus, M., Garab, G., Croce, R. & Holzwarth, A.R. (2008) Far-red fluorescence: a direct spectroscopic marker for LHCII oligomer formation in non-photochemical quenching. FEBS Lett. 582: 3625-3631.
Mustárdy, L., Buttle, K., Steinbach, G. & Garab, G. (2008) The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly. Plant Cell 20: 2552-2557.
Lambrev, P.H., Várkonyi, Zs., Krumova, S., Kovács, L., Miloslavina, Y., Holzwarth, A.R. & Garab, G. (2007) Importance of trimer–trimer interactions for the native state of the plant light-harvesting complex II. Biochim. Biophys. Acta 1767: 847-853.
Gulbinas, V., Karpicz, R., Garab, G. & Valkunas, L. (2006) Nonequilibrium heating in LHCII complexes monitored by ultrafast absorbance transients. Biochemistry 45: 9559-9565.
Mustárdy, L. & Garab, G. (2003) Granum revisited. A three-dimensional model–where things fall into place. Trends Plant Sci. 8: 117-122.
Garab, G. & Mustárdy, L. (2000) Role of LHCII-containing macrodomains in the structure, function and dynamics of grana. Funct. Plant Biol. 27: 279-279.

tudományos tanácsadó

emeritus tudományos tanácsadó

tudományos főmunkatárs

tudományos munkatárs

tudományos munkatárs

tudományos munkatárs

posztdoktor

tudományos-műszaki ügyintéző

tudományos segédmunkatárs

Ph.D. hallgató

Ph.D. hallgató

vendégkutató

vendégkutató
 LAMBREV Petar
LAMBREV Petar
|
tudományos tanácsadó | publikációk | CV |
 GARAB Győző
GARAB Győző
|
emeritus tudományos tanácsadó | publikációk | CV |
 UGHY Bettina
UGHY Bettina
|
tudományos főmunkatárs | publikációk | CV |
 AKHTAR Parveen
AKHTAR Parveen
|
tudományos munkatárs | publikációk | CV |
 MAGYAR Melinda
MAGYAR Melinda
|
tudományos munkatárs | publikációk | CV |
 RACSKÓNÉ DOMONKOS Ildikó
RACSKÓNÉ DOMONKOS Ildikó
|
tudományos munkatárs | publikációk | CV |
 SINGHAL Sumit
SINGHAL Sumit
|
posztdoktor | CV | |
 ZSIROS Ottó
ZSIROS Ottó
|
tudományos-műszaki ügyintéző | publikációk | CV |
 BÖDE Kinga
BÖDE Kinga
|
tudományos segédmunkatárs | publikációk | CV |
 DEEB Dima
DEEB Dima
|
Ph.D. hallgató | publikációk | CV |
 NAGYAPÁTI Sarolta
NAGYAPÁTI Sarolta
|
Ph.D. hallgató | publikációk | CV |
 NAGY László
NAGY László
|
vendégkutató | publikációk | CV |
 SZILÁK László
SZILÁK László
|
vendégkutató | publikációk | CV |