
A csoport története
Az Arabidopsis Molekuláris Genetika csoport 1990-ben alakult, azzal a céllal, hogy az Arabidopsis thaliana mint modellnövény felhasználásával megalapozza a környezeti stresszválasz szabályozásának molekuláris szintű kutatását. Csoportunk elsőként alkalmazott Arabidopsis modellt molekuláris genetikai kutatások céljaira Magyarországon. A kezdeti években elsősorban a technológiák kidolgozását, meghonosítását végeztük. Ebben az időben a kölni Max-Planck Intézetben dolgozó Koncz Csaba segítségével dolgoztuk ki a T-DNS inszerciós mutagenezis, a promotercsapdázás módszereit, ami lehetővé tette a genetikai analízis és a gének molekuláris jellemzésének összekapcsolását. Kidolgoztunk egy új genetikai rendszert ami alkalmas az ismeretlen szabályozó gének azonosítására, jellemzésére. Több évtizedes tevékenységünk során az extrém környezeti hatások, elsősorban a szárazság és só stressz során fellépő élettani és molekuláris változások megismerése volt kutatásaink fókuszában.
Kutatási témák
Az extrém környezet mint például a szárazság, vagy a talaj magas sótartalma ozmotikus, ionos és oxidatív stresszt okoznak a növényekben, ami gátolja azok növekedését és a mezőgazdasági termelést. Az Arabidopsis modell alkalmazásával tanulmányozzuk az ilyen körülmények molekuláris és élettani hatásait. Különböző genetikai technikákat alkalmazva több olyan szabályozó gént izoláltunk amik a stresszválaszokat szabályozzák. Kutatási programjaink elsősorban az azonosított gének és folyamatok jellemzését célozzák.
A prolin metabolizmus szabályozása és funkciói.
A szárazság vagy só stressz közben megfigyelhető prolin felhalmozódás egy ismert jelenség a növény biológiában. A prolin egy többfunkciós aminosav ami többféleképp tudja befolyásolni a növények stressztűrését: ozmoprotektív tulajdonságain keresztül, a redox egyensúly szabályozásával de metabolikus szignálként is működik (Szabados and Savouré, 2010, Alvarez et al., 2022). A prolin bioszintézis szabályozását több mint húsz éve tanulmányozzuk a laboratóriumunkban. Izoláltuk és jellemeztük a bioszintézist ellenőrző P5CS1 és P5CS2 géneket (Strizhov et al., 1987, Ábrahám et al., 2003, Fabro et al., 2004, Székely et al., 2008). Kutatásaink megerősítették, hogy a prolin felhalmozódás fontos a só stressznek kitett növények homeosztázisának fenntartása, redox egyensúlyának biztosítása érdekében (Székely et al., 2008). Az ozmotikus stressz mellett a foszfát hiány is prolin felhalmozódáshoz vezet, amit a P5CS1 gén 1. intronjában lévő szabályozó szekvenciákhoz kötődő PHR1 és PHL1 transzkripciós faktorok szabályoznak (Aleksza et al., 2017). A prolin felhalmozódást abszcizinsavtól (ABA) függő és független jelátvitel ellenőrzi, ami fényszabályozás alatt is áll (Ábrahám et al., 2003, Kovács et al., 2019). Eredményeink szerint a bZIP típusú HY5 transzkripciós faktor fontos a fénytől függő P5CS1 aktiváláshoz, ami felismeri a P5CS1 promoter G-box és C-box elemeit és ezáltal elősegíti a magas szintű génexpressziót (Kovács et al., 2019).
A folyamatban lévő kutatásaink a prolin felhalmozódás és a fotoszintézis kapcsolatának feltárására irányul, a kloroplasztiszok és a mitokondriális folyamatok valamint a prolin metabolizmus közötti kapcsolatok, a stressz, ABA és fény jelátvitel összefüggéseinek megértését célozzák.
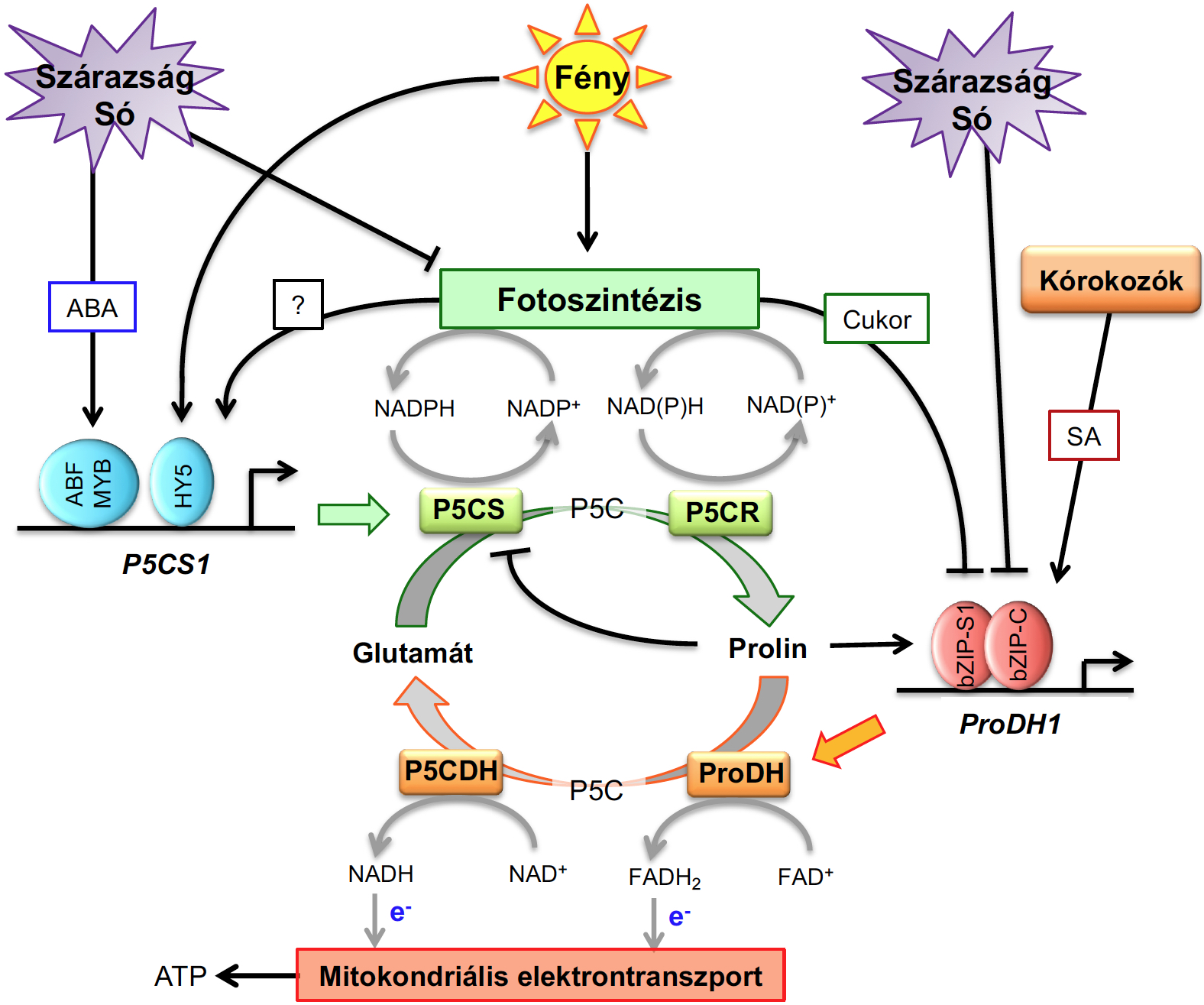
1. Ábra. A prolin metabolizmus szabályozása, a jelátviteli folyamatok kapcsolatai az Arabidopsis modellben (Alvarez et al., 2022).
A stresszválaszt szabályozó gének izolálása és jellemzése.
Az általunk kidolgozott genetikai rendszerek segítségével több olyan gént izoláltunk ami befolyásolja a növények ozmotikus, só vagy oxidatív stresszel szembeni ellenállóképességét.
A mitokondriális elektron transzport érzékeny a környezeti változásokra, és fontos a sejtek homeosztázisának fenntartása szempontjából. A mitokondriális PPR40 fehérjét kódoló gént egy genetikai szűrés során azonosítottuk. A mutáns csírázása érzékenyebb a sóra és abszcizinsavra (Zsigmond et al., 2008). Érdekes, hogy kifejlett növényekben az ABA érzékenység elősegítette a szárazságtűrést (Kant et al., 2023).
Az Arabidopsis Hősokk Faktor A4A (HSFA4A) a sejtek redox egyensúlyának stabilizálásán keresztül segíti a só, oxidatív valamint a kombinált stresszkezelésekkel szembeni toleranciát (Pérez-Salamó et al., 2014, Faragó et al., 2018, Andrási et al., 2019). A hősokk faktor család nem csak a magas hőmérséklet által okozott stresszel szemben védekezésnél, de számos más folyamat szabályozásánál is kulcs fontosságú (Andrási et al., 2021).
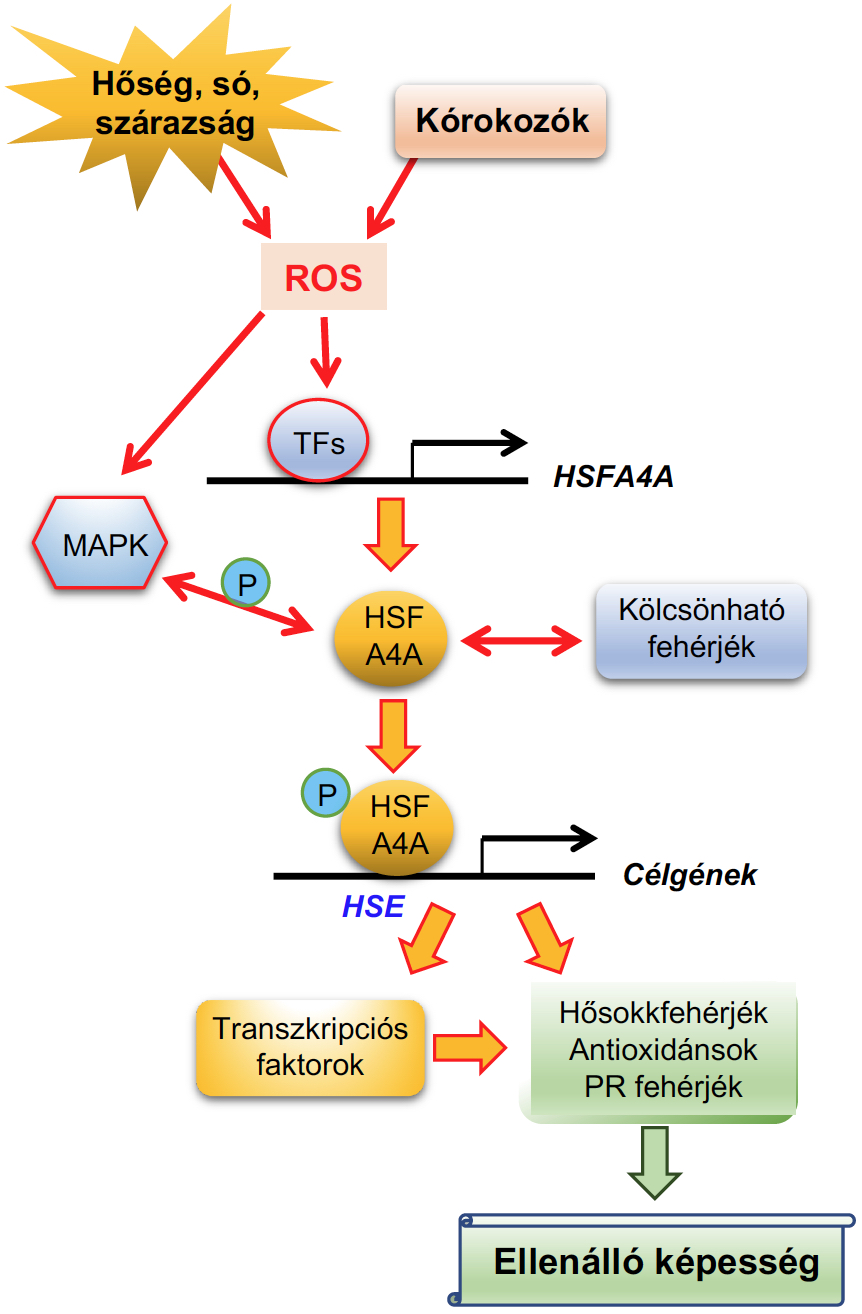
2. Ábra. A Hősokk faktor A4A szerepe a stressz jelátvitelben (Andrási et al., 2019).
A cink ujj családba tartozó ZFP3 faktor az ABA és fény jelátvitelt módosítja és ezen keresztül szabályozza a csírázást és egyedfejlődést (Joseph et al., 2014).
A ERFVII családba tartozó RAP2.12 transzkripciós faktor (és közeli rokonai RAP2.2 és RAP2.3) az anoxiával valamint az ozmotikus stresszel szembeni ellenállóképességet szabályozzák, de az ABA jelátvitelt is befolyásolják (Papdi et al., 2008, Papdi et al., 2015).
A CRK5 protein kináz az auxin transzportban szereplő PIN fehérjék foszforilációjával szabályozza a gyökér növekedést, geotropizmust, de befolyásolja az embrió fejlődést és a hipokotil megnyúlást is (Rigó et al., 2013, Baba et al., 2018, Cséplő et al., 2021).
Több gént azonosítottunk a Lepidium crassifolium nevű halofita növényből ami az Arabidopsis közeli rokona. Az izolált gének túltermelése javítja a transzgenikus Arabidopsis vonalak só, ozmotikus és oxidatív stressz tűrését (Rigó et al., 2016). A SPQ-nak elnevezett kis fehérjét kódoló gén az ABA érzékenység módosításán keresztül a szárazságtűrést is elősegíti (Faragó et el., 2022).
Módszer fejlesztés: új genetikai és képanalízis technikák kidolgozása.
Egy nemzetközi együttműködés keretében, dr. Koncz Csaba segítségével, több olyan genetikai technológia kidolgozásában vettünk részt, ami elősegítette a stresszválaszt szabályozó Arabidopsis gének izolálását és funkcionális jellemzését (Papdi et al., 2009, Papdi et al., 2010). A luciferáz riporter gén segítségével megvalósított promoter csapdázás stressz és ABA indukált gének in situ azonosítására volt alkalmas (Alvarado et al., 2004). A véletlen cDNS transzferen és túltermelésen alapuló Conditional cDNA Overexpressing System (COS) a külső indukciótól függő túltermelés révén kondicionális, domináns fenotípushoz vezet, ami különösen alkalmas a stresszválaszt szabályozó gének izolálására (Papdi et al., 2008). A rendszert sikeresen alkalmaztuk a halofita Lepidium növényből származó gének izolálására, amelyek képesek az Arabidopsis stressz toleranciájának javítására (Rigó et al., 2016).
A növények méretének, növekedésének és élettani paramétereinek vizsgálatára számos módszer áll rendelkezésre, de ezek általában anyag és munkaigényesek és az tesztelt növény feldolgozásával járnak. A nagyszámú növény egyidejű, hatékony vizsgálata céljából kidolgoztunk egy kép analízisen alapuló eljárást. A PlantSize komputer applikáció segítségével egyszerűen meg lehet határozni az in vitro körülmények között nevelt növények méretét, formáját és színét numerikus adatokat kaphatunk a növények méretéről, formájáról, antocián és klorofill tartalmáról (Faragó et al., 2018).
A PSI cég (Csehország) automata növény fenotipizáló rendszerének segítségével nagyszámú növény morfológiai és élettani jellemzőit lehet vizsgálni. A kép analízisen alapuló technológiát sikeresen alkalmaztuk a növények szárazságtűrésének jellemzése során (Faragó et al., 2022).

3. Ábra. A szárazságnak kitett Arabidopsis vonalak klorofill fluoreszcenciájának változása. A fenotipizáló rendszer kép analízise. A) Fv/Fm értékek vízmegvonás után. B) Fv/Fm értékek újralocsolás után.
Alkalmazott kutatások
A vízvesztéssel kapcsolatos epigenetikai változásokat az ozmotikus stressznek kitett repce növények hiszton módosításai illetve a genomikus DNS metilációs mintázatának változásai révén jellemezzük.
Az Arabidopsis modellnövényen végzett kutatásaink eredményeként több olyan Arabidopsis és Lepidium gént sikerült izolálni és jellemezni amik hozzájárulnak a különféle extrém hatásokkal szembeni tolerancia kialakításához (Zsigmond et al., 2008, Pérez-Salamó et al., 2014, Papdi et al., 2015, Rigó et al., 2016, Andrási et al., 2019, Faragó et al., 2022). Ahhoz hogy a géneket illetve a kapcsolt eljárásokat haszonnövényeken is alkalmazni tudjuk, elindítottunk egy repce kutatási programot, ami a klónozott gének túltermeltetését, tesztelését célozza. Amennyiben a jogi akadályok elhárulnak a genetikai transzformáció illetve genomszerkesztés elől, ezek a módszerek segíthetik a haszonnövények ellenállóképességének javítását, a klímaváltozással járó szárazság és hőhullámok mezőgazdasági hatásainak enyhítését.

4. Ábra. A SPQ túltermelő Arabidopsis növények jobban túlélik a kiszárítást mint a nem transzformált vonal. Felső sor: vadtípusú Arabidopsis, középső és alsó sor: SPQ túltermelő Arabidopsis újraéledése kiszírítás után.
A kutatásaink során előállított, hozzáférhető kutatási anyagok, technológiák
40.000 transzgenikus Arabidopsis vonal amik egy vagy több Lepidium cDNS inszertet tartalmaznak (Lepidium COS könyvtár) (Rigó et al., 2016).
PlantSize képanalizáló szoftver (Faragó et al., 2018). PlantSize
A hajtás és gyökér fejlődés jellemzésére alkalmas növény fenotipizálási technológia.
Oktatási tevékenység
Csoportunk aktívan résztvesz a hazai és külföldi diákok, fiatal kutatók pre és posztgraduális oktatásában. Eddig 15 M.Sc diák, és 16 Ph.D. hallgató szerezte meg tudományos fokozatát a csoportunkban, akik kutatóink irányításával végezték a tézisekhez illetve publikációkhoz szükséges tudományos kutatásaikat. Csoportunk aktív volt az International Training Course (ITC) keretében megvalósult posztgraduális oktatási programban is. Kutatóink rendszeresen előadásokat, speciális kurzusokat tartanak a Szegedi Tudományegyetemen valamint a kolozsvári Babes-Bólyai egyetem magyar tagozatán. Jelenleg egy magyar és két külföldi PhD hallgató végzi kutatásait csoportunkban.
Tudomány népszerűsítés
Csoportunk évek óta résztvesz a tudomány népszerűsítését szolgáló eseményeken, bemutatókon mint például a „Kutatók éjszakája” program. Ezen kívül több, a szélesebb közönséget megcélzó kiadvány létrejöttéhez is hozzájárultunk (Szabados, 2014, Szabados, Györgyey, 2015). Az különleges körülményekhez alkalmazkodó növényekről jelenik meg a Kaleidoszkóp Könyvek sorozat „Extremofil növények” című kiadványa (Szabados, 2023).
Nemzetközi és hazai együttműködések
Dr. Koncz Csaba, Max-Planck-Institute für Züchtungsforschung, Köln, Germany,
Prof. Arnould Savouré, University of Paris Marie-Curie, Paris, France
Prof. Aviah Zilberstein, Tel-Aviv University, Tel-Aviv, Israel,
Prof. Sabina Vidal, University of Montevideo, Uruguay
Dr. Santiago Signorelli, University of Montevideo, Uruguay
Prof. Maria Elena Alvarez, University of Córdoba, Argentina
Prof. P.V.Shivaprasad, NCBS, Bangalore, India
Dr. Csiszár Jolán, Szegedi Tudományegyetem, Szeged
Dr. Kolbert Zsuzsanna, Szegedi Tudományegyetem, Szeged
Dr. Szarka András, Budapesti Műszaki Egyetem, Budapest
Válogatott publikációk
1. Ábrahám E, Rigó G, Székely G, Nagy R, Koncz Cs, Szabados L (2003) Light-dependent induction of proline biosynthesis by abscisic acid and salt stress is inhibited by brassinosteroid in Arabidopsis. Plant Mol. Biol 51:363-372.
2. Aleksza D, Horváth GV, Sándor Gy, Szabados L (2017) Proline Accumulation Is Regulated by Transcription Factors Associated with Phosphate Starvation. Plant Physiol 175:555-567
3. Alvarez ME, Savouré, A, Szabados, L. (2022) Proline metabolism as regulatory hub. Trends Plant Sci 27: 39-55.
4. Andrási N, Rigó G, Zsigmond Zs, Pérez-Salamó I, Papdi Cs, Klement E, Pettkó-Szandtner A, Baba A-I, Ayaydin F, Dasari R, Cséplő A, Szabados L (2019) The MPK4-phosphorylated Heat Shock Factor A4A regulates responses to combined salt and heat stresses. J. Exp. Bot. 70:4903-4918.
5. Andrási N, Pettko-Szandtner A, Szabados L (2021) Diversity of Plant Heat Shock Factors: Regulation, Interactions and Functions. J. Exp. Bot. 72(5):1558-1575.
6. Baba AI, Rigó G, Ayaydin F, Rehman AU, Andrási N, Zsigmond L, Valkai I, Urbancsok J, Vass I, Pasternak T, Palme K, Szabados L, Cséplő Á (2018) Functional analysis of the Arabidopsis thaliana CDPK-Related kinase family: AtCRK1 regulates responses to continuous light. Int. J. Mol. Sci. 19: 1282.
7. Cséplő Á, Zsigmond, L, Andrási, N, Baba, A.i., Labhane, N., Pető, A., Kolbert, Zs., Kovács, H.E., Steinbach, G., Szabados, L., Fehér, A., Rigó, G. (2021) The AtCRK5 Protein Kinase Is Required to Maintain the ROS NO Balance Affecting the PIN2-Mediated Root Gravitropic Response in Arabidopsis. Int J Mol Sci. 22:5979.
8. Fabro G, Kovács I, Pavet, V, Szabados L, Alvarez, ME (2004) Proline accumulation and AtP5CS2 gene activation are induced by plant-pathogen incompatible interactions in Arabidopsis. Mol Plant Micr Interaction 17:343-350.
9. Faragó D, Sass L, Valkai I, Andrási N, Szabados L (2018) PlantSize offers an affordable, non-destructive method to measure plant size and color in vitro. Front. Plant Sci. 9:219.
10. Faragó D, Zsigmond L, Benyó D, Alcázar R, Rigó G, Ayaydin F, Rabilu S-A, Hunyadi-Gulyás É, Szabados L (2022) Small paraquat resistance proteins modulate paraquat and ABA responses and confer drought tolerance to overexpressing Arabidopsis plants. Plant Cell Environ, 45:1985-2003
11. Joseph MP, Papdi C, Kozma-Bognar L, Nagy I, Lopez-Carbonell M, Koncz C, Szabados L (2014) The Arabidopsis Zinc Finger Protein 3 interferes with ABA and light signaling in seed germination and plant development. Plant Physiol 165(3):1203-1220
12. Kant K, Rigó G, Faragó D, Benyó D, Szabados L, Zsigmond L (2023) The Arabidopsis mitochondrial Pentatricopeptide repeat 40 protein modulates drought tolerance. Planta (accepted).
13. Kováts H, Aleksza D, Baba AI, Hajdu A, Kiraly AM, Zsigmond L, Tóth SZ, Kozma-Bognár L, Szabados L (2019) Light control of salt-induced proline accumulation is mediated by ELONGATED HYPOCOTYL 5 in Arabidopsis. Front. Plant Sci. 10:1584.
14. Papdi Cs, Ábrahám E, Joseph MP, Popescu C, Koncz Cs, Szabados L (2008) Functional identification of Arabidopsis stress regulatory genes using the Controlled cDNA Overexpression System, COS. Plant Physiol. 147: 528–542.
15. Papdi Cs, Pérez-Salamó I, Joseph MP, Giuntoli B, Bögre L, Koncz Cs, Szabados L (2015) The low oxygen, oxidative and osmotic stress responses synergistically act through the Ethylene Response Factor-VII genes RAP2.12, RAP2.2 and RAP2.3. Plant J. 82: 772-784
16. Perez-Salamo I, Papdi C, Rigó G, Zsigmond L, Vilela B, Lumbreras V, Nagy I, Horvath B, Domoki M, Darula Z, Medzihradszky K, Bögre L, Koncz C, Szabados L (2014) The Heat Shock Factor A4A Confers Salt Tolerance and Is Regulated by Oxidative Stress and the Mitogen-Activated Protein Kinases MPK3 and MPK6. Plant Physiol 165: 319-334.
17. Rigó G, Tietz O, Ayaydin F, Zsigmond L, Kovács H, Páy A, Salchert K, Szabados L, Palme K, Koncz Cs, Cséplö Á (2013) Inactivation of plasma-membrane localized CDPK-related kinase 5 decelerates PIN2 exocytosis and root gravitropic response. Plant Cell 25:1592-1608.
18. Rigó, G., Valkai, I., Faragó, D., Kiss, E., Van Houdt, S., Van de Steene, N., Hannah, M. A., and Szabados, L. (2016) Gene mining in halophytes: functional identification of stress tolerance genes in Lepidium crassifolium. Plant, Cell & Environment, 39:2074-2084.
19. Szabados L, Savouré A (2010) Proline: a multifunctional amino acid. Trends Plant Sci 15:89-97.
20. Strichov N, Ábrahám E, Ökrész L, Blickling S, Zilberstein A, Schell J, Koncz C, Szabados L (1997) Differential expression of two P5CS genes controlling proline accumulation during salt-stress is regulated by ABA1, ABI1 and AXR2 in Arabidopsis. Plant J. 12:557-569.
21. Székely Gy, Ábrahám E, Cséplő Á, Rigó G, Zsigmond L, Csiszár J, Ayaydin F, Strizhov N, Jásik J, Schmelzer E, Koncz Cs, Szabados L (2008) Duplicated P5CS genes of Arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthessis. Plant J. 53:11-28.
22. Zsigmond L, Rigó G, Székely Gy, Ötvös K, Szarka A, Darula Zs, Medzihradszky KF, Koncz Cs, Koncz Zs, Szabados L (2008) Arabidopsis PPR40 connects abiotic stress responses to mitochondrial electron transport. Plant Physiol. 146:1721-1737.
Tudományt népszerűsító kiadványok
Szabados L (2014) A szárazság és sótűrés szabályozása a virágos növényekben. In.: A Növények Molekuláris Biológiájától a Zöld Biotechnológiáig. Ed.: Fehér A., Györgyey J. Akadémiai Kiadó, Budapest, pp. 192-210.
Szabados L., Györgyey J (2015) Molecular background of stress tolerance: lessons from plant systems. In: Selected Topics from Contemporary Experimental Biology. Biological Research Centre, Szeged, Hungary, Eds: Csaba Vágvölgyi, László Siklós, Vol. 2. pp. 209-224.
Szabados L (2023) Extremofil növények. Növényi élet szélsőséges körülmények között. Kaleidoszkóp Könyvek kiadványsorozat, Libri Könyvkiadó, Budapest. 136 oldal.
Bejelentett szabadalmak
Szabados L, Zsigmond L, Koncz Cs: Improvement of stress tolerance in higher plants. Patent Application No.: P0500811, date: 31/08/2005
Szabados L, Koncz C, Ábrahám E, Papdi C, Joseph MP (2008) Controlled cDNA Overexpression System in Arabidopsis, Hungarian Patent No.: P0800351, 2008.05.30.

tudományos tanácsadó

tudományos főmunkatárs

tudományos főmunkatárs

tudományos-műszaki ügyintéző

tudományos munkatárs

posztdoktor

tudományos segédmunkatrás

PhD hallgató

PhD hallgató

laboráns
 SZABADOS László
SZABADOS László
|
tudományos tanácsadó | publikációk | CV |
 ZSIGMOND Laura
ZSIGMOND Laura
|
tudományos főmunkatárs | publikációk | CV |
 RIGÓ Gábor
RIGÓ Gábor
|
tudományos főmunkatárs | publikációk | CV |
 BENYÓ Dániel
BENYÓ Dániel
|
tudományos-műszaki ügyintéző | publikációk | CV |
 VALKAI Ildikó
VALKAI Ildikó
|
tudományos munkatárs | publikációk | CV |
 PRASAD Melvin
PRASAD Melvin
|
posztdoktor | publikációk | CV |
 KANT Kamal
KANT Kamal
|
tudományos segédmunkatrás | CV | |
 RABILU Sahilu Ahmad
RABILU Sahilu Ahmad
|
PhD hallgató | ||
 MARTICS Atina
MARTICS Atina
|
PhD hallgató | CV | |
 KIRÁLY Anna Mária
KIRÁLY Anna Mária
|
laboráns |