
Fehérje spektroszkópia laboratórium
A fehérjék működésének fizikai alapjai
A fehérjék működésének fizikai alapja az elektrosztatikus kölcsönhatás töltések és dipólusok között; az elektronaffinitás és az ezzel kapcsolatos elektrontranszfer reakciók; a protonaffinitás (pK) és az ezzel kapcsolatos protontranszfer reakciók, valamint hidrogénhidak; sztérikus kölcsönhatások a fehérje térbeli szerkezetének függvényében; valamint a fehérje belsejében lévő és a fehérjével határos vízmolekulákkal, továbbá membránfehérjék esetén a lipidekkel való kölcsönhatások. Kromofór prosztetikus csoportokkal rendelkező fehérjék esetében a látható-UV tartományba eső spektroszkópiai és kinetikus spektroszkópiai vizsgálatok fontos információkat szolgáltatnak a megfelelő fehérjék működéséről.
Tanulmányozzuk ionpumpa bakteriális retinálfehérjék, pl. bakteriorodopszin fotociklusát és a protontranszport molekuláris lépéseit, ill. fényérzékeny jelzőmolekulák, pl. a PYP fotociklusát, ezek környezeti hatásoktól való függését. Vizsgáljuk az elektrontranszfer kinetikáját meghatározó fehérjeszerkezeti tulajdonságokat citokróm fehérjékben. Általános kemometriai módszereket fejlesztünk és alkalmazunk spektrális adatmátrixok kiértékelésére, a spektrális adatok mögött rejlő fizikai tartalom meghatározására. Foglalkozunk továbbá „színes” fehérjék felhasználásának lehetőségeivel bioelektronikai és biofotonikai alkalmazásokban.
Fő kísérleti berendezésünk egy hangolható Nd-Yag + OPO impulzuslézerből, ami < 10 nanoszekundumos gerjesztő lézerimpulzusokat szolgáltat, és egy, a teljes látható tartományban folytonos fehér mérőfényt szolgáltató fényforrásból áll. Időfelbontott spektrumokat mérünk a gerjesztett mintán diszkrét késleltetéssel a <100 nanoszekundum tartománytól felfelé, továbbá nagy időfelbontással mérünk egyhullámhosszas kinetikákat ugyanabban a mérési elrendezésben.
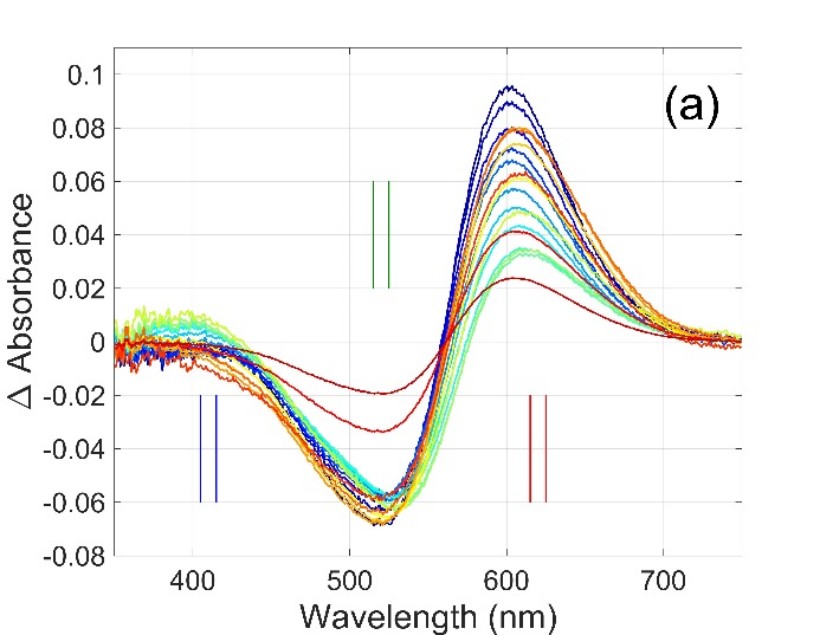
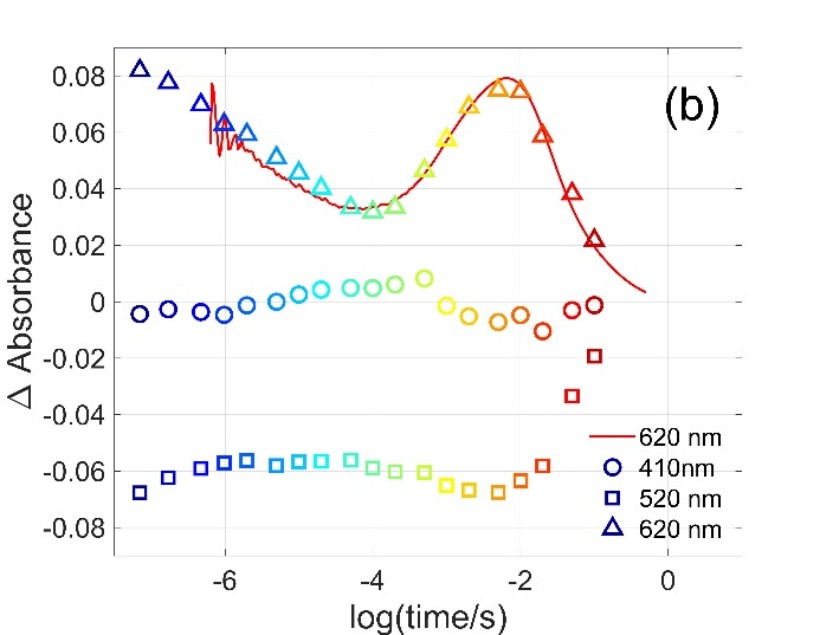
1. ábra. Teljes spektrumú és egyhullámhosszas időfelbontott abszorpcióváltozás jelek Gloeobacter rodopszin fehérjén mérve [1]. A (b) ábrán a szimbólumok megfelelnek az (a) ábráról, a kiemelt hullámhosszoknál leolvasott amplitúdóknak.
A citokróm b561 fehérjék szerkezete és működése
A citokróm b561 fehérjék aszkorbát-redukálható, 6 transzmembrán hélixet és két, a membrán két széléhez közeli hem b kofaktort tartalmazó fehérjék eukarióta sejtekben. Ezeket a fehérjéket a citoplazmatikus oldalon az aszkorbát redukálja, a felvett elektront a két hem kofaktoron keresztül átszállítják a membránon, és a másik oldalon monodehidroaszkorbátot, vas(III) iont vagy egyelőre ismeretlen szubsztrátot redukálnak. A fehérjecsalád több tagját jellemeztük spektrális és redox tulajdonságaik, szubsztrátkötő paramétereik szerint, és vizsgáljuk a konzervált aminosavak és szerkezeti felépítésük szerepét a betöltött funkciójukban homológia modellezés és AlphaFold szerkezeti modellek alapján.
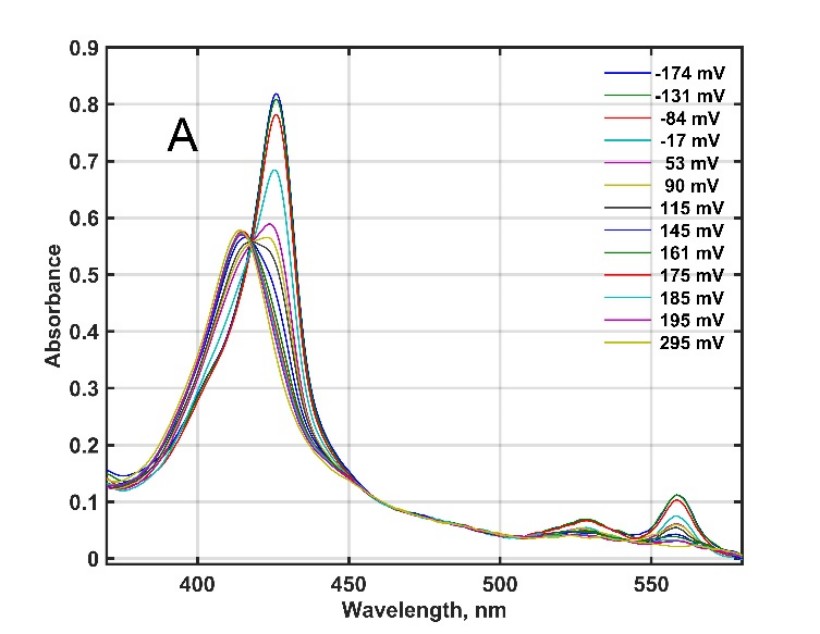
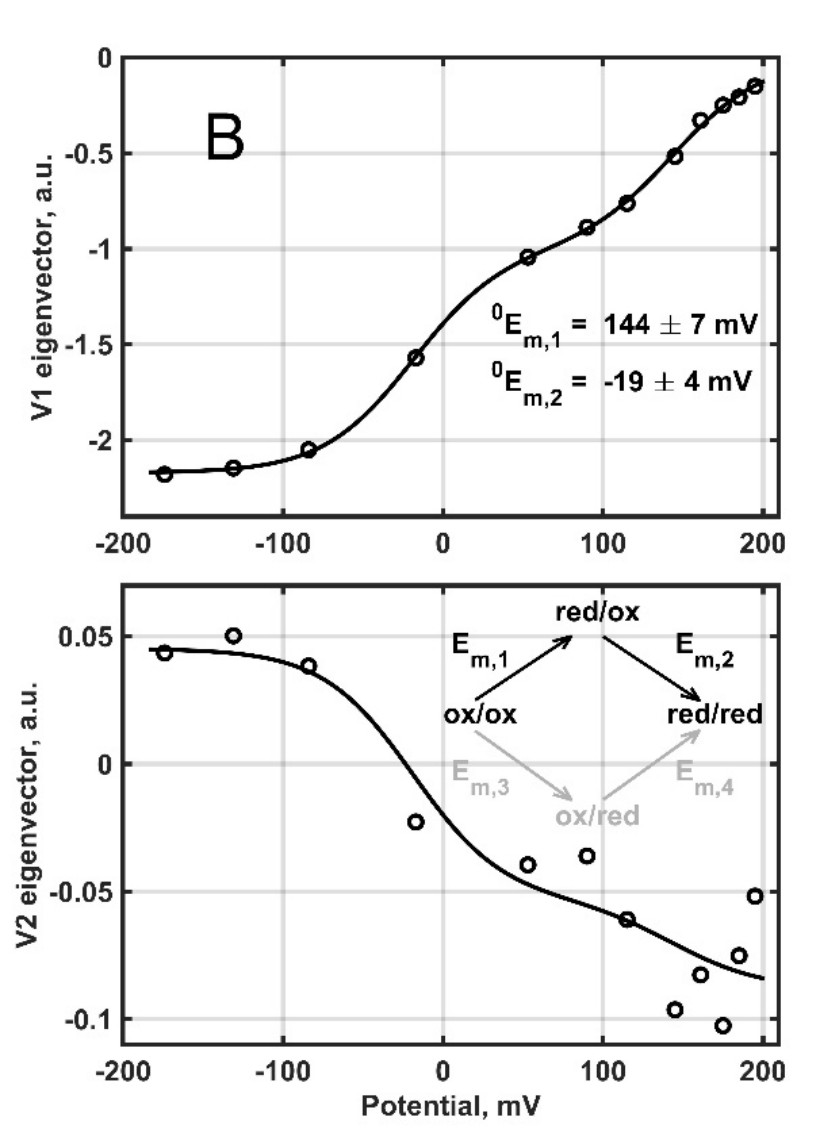
2. ábra. Az egyelőre ismeretlen funkciójú, egér citokróm b561 D1 fehérje redox titrálása és a két kofaktorral összhangban álló általános modell illesztése [2].
Porózus szilícium alapú biofotonika
Összetett biofotonikai struktúrát hoztunk létre úgy, hogy porózus szilícium (PSi) mikrokavitásba juttattunk fotoaktív sárga fehérjét (photoactive yellow protein PYP) [3]. Ezzel a “proof-of-concept” mintával fényindukált optikai választ (reflektanciaváltozást) tudtunk kiváltani a fotokróm fehérje nemlineáris optikai tulajdonságaival és fotociklus kinetikájával összhangban, a mikroszekundumos időtartományban.
Femtobiológia laboratórium
Femtoszekundumos időfelbontású fluoreszcencia spektroszkópia
Laboratóriumunkban a közelmúltban felépítettünk egy olyan mérőberendezést, amely alkalmas a fluoreszcencia kinetika detektálásra 100 fs – 10 ns időintervallumban és a teljes látható spektrális tartományban. A mérőeszközön elsősorban a redox rendszerekben alapvető funkciót ellátó FAD és NADH koenzimeket vizsgálunk különböző mikrokörnyezetben. Megállapítottuk, hogy vizes oldatban a FAD fluoreszcencia kinetikája (3. ábra) több időállandóval jellemezhető: a ns időtartományba eső komponens a molekula nyitott, a ps időtartományban megfigyelt három komponens pedig a zárt konformációihoz rendelhető. A különböző konformációs állapotot felvevő molekulák számának arányát szabályozó Hofmeister effektus hatása jól megfigyelhető a kinetikákon, és egybeesik a molekuladinamikai számításokkal alátámasztott modellekkel. A mérőrendszer lehetővé teszi a ~100 fs időállandóval jellemezhető Stokes-eltolódás és az ezzel kapcsolatos szolvatációs dinamika tanulmányozását is. A fentiektől eltérően a flavocitokróm C szulfid dehidrogenáz enzimhez kötött FAD esetén egyetlen szub-ps-os komponens volt megfigyelhető, ami azt támasztja alá, hogy a koenzim rendkívül erős kapcsolatban áll a fehérje mikrokörnyezettel. A NADH koenzim esetében szintén követhető volt a nyitott és zárt konformációk egyensúlya, itt azonban a Stokes-eltolódás három komponensű, ami szokatlanul bonyolult vibrációs relaxációs folyamatra utal.
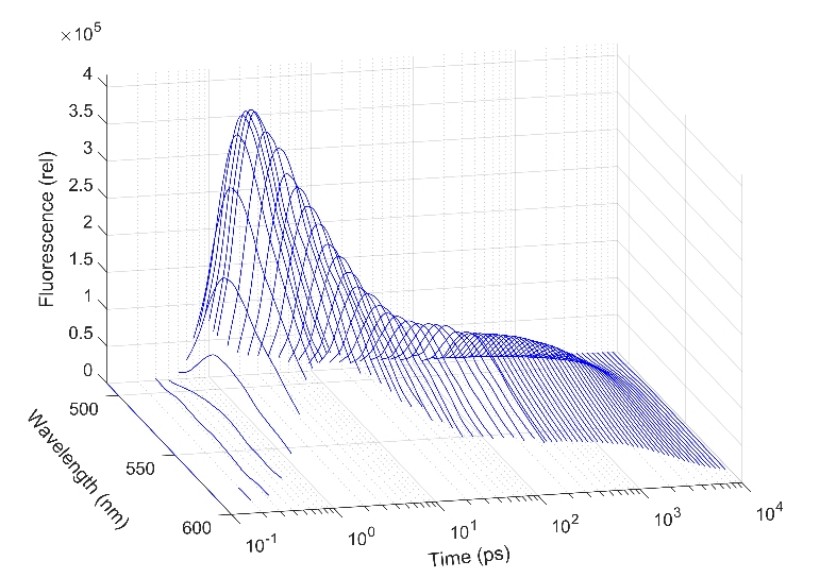
3. ábra. A FAD fluoreszcencia kinetikája idő- és hullámhossz tartományban
Komplex elsőrendű reakciókinetikai rendszerek analízise
A fentiekben bemutatott, gerjesztett állapotban végbemenő reakciók elsőrendű kinetikával jellemezhetők, csakúgy, mint például a retinálfehérjék fényindukcióját követő, már alapállapotban lévő intermedierek reakciói. Ilyen típusú komplex reakciók szokásos analízise az exponenciális komponensekkel való nemlineáris regresszió módszerén alapul, amelynek alkalmazása számos nehézségbe ütközik. A legnagyobb problémát az okozza, hogy az illesztési feladat megoldása instabil, azaz kis zaj a kísérletei adatokon nagy bizonytalanságot okoz a prediktált paramétereken, így már a ténylegesen szükséges paraméterek számában is. A bakteriorodopszin fotociklusának egy igen komplex modelljére alapozott szimulációs adatokat felhasználva a fenti probléma kezelésére egy új eljárást dolgoztunk ki [5]. Ennek lényege, hogy diszkrét exponenciálisok helyett az időállandó függvényében folytonos eloszlással jellemezzük a megoldást, a regresszió instabilitást pedig két regularizációs tag hozzáadásával kezeljük. Az egyik regularizációs tag súlya () az eloszlás csúcsainak számát, azaz a kiválasztott modell komplexitását, a másik () azok szélességét szabályozza. A modern statisztika módszereit (keresztvalidáció, Bayes-féle optimalizálás) alkalmazva egy gépi tanulási módszert fejlesztettünk ki, amely e két hiperparaméter megfelelő értékét automatikusan, kizárólag a szimulált kísérleti adatokra és a rajtuk lévő zaj szintjére alapozva képes meghatározni (4. ábra). Ez az eljárás kitűnően alkalmazható a kísérletileg meghatározott fluoreszcencia kinetikák elemzésére is.
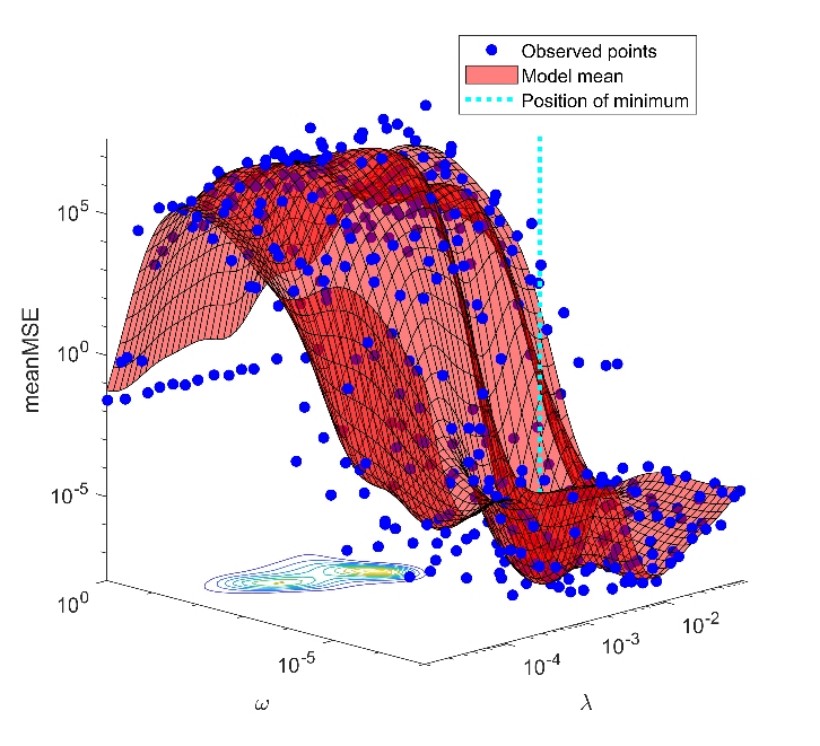
4. ábra. A hiperparaméterek megválasztása a keresztvalidációs hiba minimumánál
Multifunkcionális femtobiológiai munkaállomás kifejlesztése
Egy közelmúltban elnyert pályázat lehetővé tette, hogy a szegedi ELI ALPS lézeres kutatóközpont egyedülálló infrastruktúrájára alapozva az SZBK és a Pécsi Tudományegyetem csoportjaival együttműködve kifejlesszünk egy állandó munkaállomást, amely a fényenergiát felhasználó biológiai rendszerekben (fénybegyűjtő komplexek és fotoszintetikus reakciócentrumok, retinálfehérjék, növényi fotoreceptorok) fellépő ultragyors folyamatok tanulmányozására szolgál. Méréstechnikailag ez részben a legkorszerűbbnek számító femtoszekundumos multidimenziós elektronikus spektroszkópia technológiáin, részben pedig a fényindukált kis intenzitású koherens THz sugárzás detektálására általunk korábban kidolgozott eljárás továbbfejlesztésén alapul. A munkaállomás a teljes kifejlesztés befejezése után nyilvánosan elérhető lesz a felhasználók számára.
Atomi erő (AFM) és Raman mikroszkópia laboratórium
Pásztázószondás és konfokális Raman mikroszkópia biológiai alkalmazásai
A pásztázó tűszondás mikroszkópia laboratórium kialakításának úttörő feladata Dr. Váró György nevéhez köthető. Elhivatottságának és tudásvágyának szellemében a laboratórium azóta is biológiai objektumok – egyedi fehérjéktől élő sejteken át különböző szövetekig - strukturális, morfológiai, valamint mechanikai vizsgálatainak helyszíne. A nanométer tartományba eső manipuláció, illetve mechanikai képalkotás jelentős előnyökkel járhat a hagyományos mikroszkópokhoz viszonyítva. A széles mérési skála az egyedi molekulák közti, pico-Newton tartományba eső kölcsönhatásoktól az élő sejtek közötti nano-Newton tartományon át mikro-Newton tartományig is kiterjedhet. Ezen intercelluláris erők mérése fontos ismereteket szolgáltathat például metasztatikus folyamatok mechanikai aspektusainak tanulmányozásában. Egyik kiemelkedő témája a laboratóriumban folyó kísérleteknek a tumor sejt – agyi endotélsejtek közötti mechanikai kölcsönhatások vizsgálata, amik az agyi metasztázisok kialakulásához elengedhetetlenek [8]. A 6. ábra egy élő tumor sejt és agyi endotélsejtek közötti kapcsolódási térképet jelenít meg, ahol a topográfia a kapcsolat erősségét jelző erők nagyságával van szinezve.
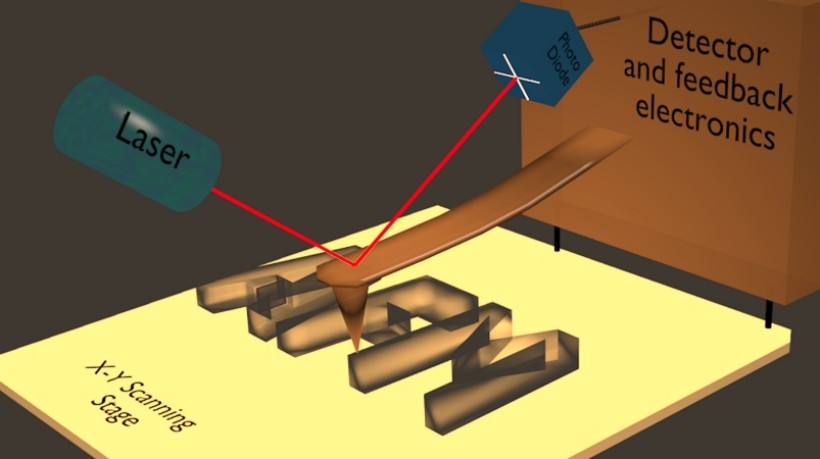
5. ábra. Az atomi erő mikroszkóp működésének vázlata
Az atomi erő mikroszkópia Raman fényszóráson alapuló jelölésmentes kémiai képalkotással kiegészítve sokoldalú fiziko-kémiai vizsgálati módszer lehet biológiai minták esetében is. Ezek közül egyre hangsúlyosabban emelkedik ki különböző gyógy- és vegyszerek sejteken belüli eloszlásának pusztán fényszóródáson alapuló detektálása, illetve tumor sejtek normál sejtektől való diszkriminációjának lehetősége. A rendszer saját kutatási területeink, illetve kollaborációs projektek kiszolgálására egyaránt lehetőséget biztosít.
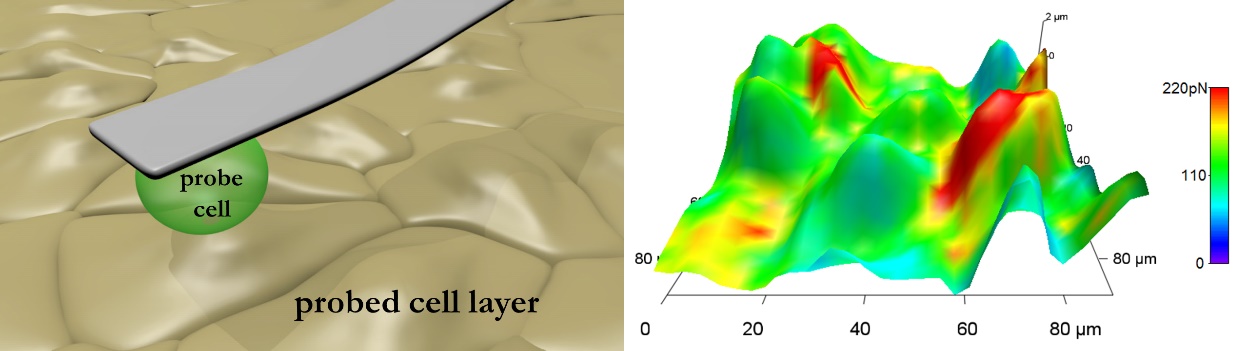
6. ábra. Balra az intercelluláris erők feltérképezéséhez használt mérési elrendezés vázlata. Jobbra a sejtek között kialakuló adhéziós erővel színezett topográfia [9].
Az eddig vizsgált objektumokat széles témaválaszték jellemezte: oligonukleotidok önszerveződésétől, nano és mikrovezikulák, baktériumok morfológiai vizsgálatán, vörösvértestek plaszticitásán, agyi endotélsejtek morfológiai, illetve tapadási mintázatának feltárásán át különböző szövetminták rugalmassági térképezéséig. A felsorolás távolról sem teljes, csupán a rendszer alkalmazhatóságának széles tartományából hivatott izelítőt nyújtani.
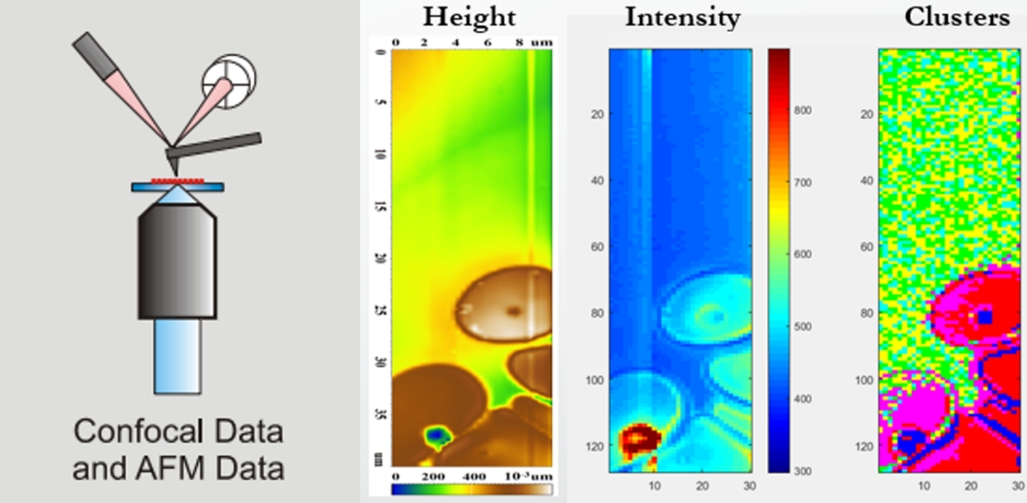
7. ábra. Az atomi erő mikroszkóppal kombinált konfokális Raman spektroszkópia mérési vázlata. A hamis színezett ábrák ugyanazon vörösvértestek topográfiai, Raman fényszórás-intenzitási illetve spektrális elkülönülési megjelenítései.
Misra, R., Das, I., Dér, A., Steinbach, G., Shim, J-G., Busse, W., Jung, K-H., Zimányi, L. and Sheves, M. 2023. Impact of protein-chromophore interaction on the retinal excited state and photocycle of Gloeobacter rhodopsin: role of conserved tryptophan residues. Chemical Science 14:9951.
Bérczi, A., Márton, Z., Laskay, K., Tóth, A., Rákhely, G., Duzs, Á., Sebők-Nagy, K., Páli, T. and Zimányi, L. 2023. Spectral and redox properties of a recombinant mouse cytochrome b561 protein suggest transmembrane electron transfer function. Molecules 28(5):2261.
Petrovszki, D., Valkai, S., Kelemen, L., Nagy, L., Agarwal, V., Krekic, Sz., Zimányi, L. and Dér, A. 2023. Microsecond all-optical modulation by biofunctionalized porous silicon microcavity. Nanomaterials 13:2070.
Khoroshyy, P., Tenger, K., Chertkova, R.V., Bocharova, O.V., Kirpichnikov, M.P., Borovok, N., Groma, G.I., Dolgikh, D.A., Kotlyar, A.B. and Zimányi, L. 2021. Kinetics and energetics of intramolecular electron transfer in single-point labeled TUPS-cytochrome c derivatives. Molecules 26(22):6976.
Zimányi, L., Sipos, Á., Sarlós, F., Nagypál, R. and Groma, G. 2021. Machine learning-based model selection and parameter estimation from kinetic data of complex first-order reaction systems. PLOS One 16(8): e0255675.
Krekic, S., Zakar, T., Gombos, Z., Valkai, S., Mero, M., Zimányi, L., Heiner, Z. and Dér, A. 2020. Non-linear optical investigation of microbial chromoproteins. Front. Plant Sci 11:547818.
Zimányi, L., Thekkan, S., Eckert, B., Condren, A.R., Dmitrenko,O., Kuhn, L.R., Alabugin, I.V. and Saltiel, J. 2020. Determination of the pKa values of trans-Resveratrol, a Triphenolic Stilbene, by Singular Value Decomposition. Comparison with Theory. J. Phys. Chem. A 124(31):6294-6302.
Varga, B., Fazakas, C., Molnár, J., Wilhelm, I., Domokos, R.A., Krizbai, I.A., Szegletes, Z., Váró, G., and Végh, A.G. 2017. Direct mapping of melanoma cell - endothelial cell interactions. J. Mol. Recognit. 30(6):e2603.
Fazakas, C., Kozma, M., Molnár, K., Kincses, A., Dér, A., Fejér, A., Horváth, B., Wilhelm, I., Krizbai, I.A., and Végh, A.G. 2021. Breast adenocarcinoma-derived exosomes lower first-contact de-adhesion strength of adenocarcinoma cells to brain endothelial layer. Colloids Surf. B Biointerfaces 204, 111810.
Csonti, K., Fazakas, C., Molnár, K., Wilhelm, I., Krizbai, I.A., and Végh, A.G. 2024. Breast adenocarcinoma cells adhere stronger to brain pericytes than to endothelial cells. Coll. And Surf. B, in press.


tudományos tanácsadó

tudományos munkatárs

tudományos munkatárs

ügyvivő szakértő

PhD hallgató
 ZIMÁNYI László
ZIMÁNYI László
|
tudományos tanácsadó | publikációk | CV |
 VÉGH Attila Gergely
VÉGH Attila Gergely
|
tudományos munkatárs | publikációk | CV |
 SIPOS Áron
SIPOS Áron
|
tudományos munkatárs | publikációk | CV |
 SARLÓS Ferenc
SARLÓS Ferenc
|
ügyvivő szakértő | publikációk | CV |
 CSONTI Katalin
CSONTI Katalin
|
PhD hallgató | publikációk | CV |